
【题目】(1)基态O原子核外电子排布式为_______,基态P原子核外占据最高能级的电子云轮廓图为_________形;
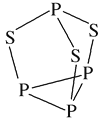
(2)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为___________,每个P4S3分子中含孤电子对的数目为_______。
(3)Na、O、S简单离子半径由大到小的顺序为__________
(4)SO2易溶于水,在水中的溶解度为1体积的水溶解40体积的SO2,原因是________。
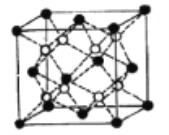
(5)Li2O的晶胞如图所示(其中白球代表Li,黑球代表O)。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式即可)。
【答案】1s22s22p4 哑铃 sp3 10 S2->O2->Na+ SO2是极性分子,水是极性分子构成的溶剂,根据相似相容原理,SO2易溶于水 ![]()
【解析】
(1)O原子核外有8个电子,根据构造原理书写基态O原子核外电子排布式;p能级电子的电子云轮廓图为哑铃形;
(2)根据图像,P、S最外层均满足8电子稳定结构,S形成2个共键单键,且S上有2个孤电子对,P上有1个孤电子对;
(3)一般而言,离子核外电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(4)根据相似相容原理分析解答;
(5)根据均摊法计算晶胞中Li+和O2-个数,求出晶胞质量和体积,最后计算Li2O的密度。
(1)O原子核外有8个电子,根据构造原理,基态O原子核外电子排布式为1s22s22p4;基态P原子核外占据最高能级的电子为3p能级电子,s能级电子的电子云轮廓图为球形,p能级电子的电子云轮廓图为哑铃形,则基态P原子核外占据最高能级的电子云轮廓图为哑铃形,故答案为:1s22s22p4;哑铃;
(2)根据分子结构示意图,S原子形成2个共键单键,且S上有2个孤电子对,则P4S3分子中硫原子的杂化轨道类型为sp3;每个S原子上有2个孤电子对,P原子上有1个孤电子对,则每个P4S3分子中含孤电子对的数目为10,故答案为:sp3;10;
(3)一般而言,离子核外电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,离子核外电子层数S2-最多,离子半径最大,O2-、Na+核外电子层数相同,且原子序数O<Na,则离子半径从大到小顺序是S2->O2->Na+,故答案为:S2->O2->Na+;
(4)SO2中S原子形成2个共价键,且S上有1个孤电子对,采用sp2杂化,为V形结构,是极性分子,水是极性分子构成的溶剂,根据相似相容原理,SO2易溶于水,在水中的溶解度为1体积的水溶解40体积的SO2,故答案为:SO2是极性分子,水是极性分子构成的溶剂,根据相似相容原理,SO2易溶于水;
(5)该晶胞中Li+个数=8、O2-个数=8×![]() +6×
+6×![]() =4,晶胞质量=
=4,晶胞质量=![]() g,晶胞体积=(0.4665×10-7cm)3,则Li2O的密度=
g,晶胞体积=(0.4665×10-7cm)3,则Li2O的密度=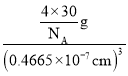 =
= ![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】Mg-LiFePO4电池的电池反应为![]() ,其装置示意图如下:(锂离子导体膜只允许Li+通过)。下列说法正确的是
,其装置示意图如下:(锂离子导体膜只允许Li+通过)。下列说法正确的是

A.放电时,Li+被还原
B.放电时,电路中每流过2 mol电子,有1 mol Mg2+迁移至正极区
C.充电时,阳极上发生的电极反应为:![]()
D.充电时,导线上通过1 mol电子,左室溶液质量减轻12 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列几种离子晶体,说法不正确的是( )
A.由于![]() 晶体和
晶体和![]() 晶体中正、负离子半径比
晶体中正、负离子半径比![]() 不相等,所以两晶体中离子的配位数不相等
不相等,所以两晶体中离子的配位数不相等
B.![]() 晶体中,
晶体中,![]() 配位数为8,
配位数为8, ![]() 配位数为4,不相等,主要是由于
配位数为4,不相等,主要是由于![]() 、
、![]() 电荷数(绝对值)不相同
电荷数(绝对值)不相同
C.![]() 的熔点比的
的熔点比的![]() 高主要是因为
高主要是因为![]() 的晶格能比
的晶格能比![]() 大
大
D.![]() 晶体固态时也能导电
晶体固态时也能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期元素性质的部分数据如下表,其中x的值表示不同元素的原子吸引电子的能力大小,若x值越大,元素的非金属性越强,金属性越弱。x值相对较大的元素在所形成的分子中化合价为负。⑩原子的核外电子层数与核外电子总数相同。
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
x | 3.44 | 2.55 | 0.98 | 3.16 | 2.19 | 3.98 | 0.93 | 3.04 | 1.91 | |
常见化合价 | 最高价 | +4 | +1 | +1 | +4 | |||||
最低价 | -2 | -1 | -3 | -1 | -3 | |||||
(1)根据以上条件,推断③④⑤的元素符号分别为:___,__,__。
(2)②的最高价氧化物的固体属于__晶体,空间构型__。
(3)用电子式表示下列原子相互结合成的化合物电子式:
①+⑦+⑩:___,
①+⑩形成原子个数比为1:1的化合物:__。
(4)写出①与⑦所形成仅含离子键的化合物和④与⑩所形成的化合物反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁常用于制备其它超硬、高导热、耐高温的氮化物,实验室用以下装置制取氮化镁。已知:Mg+2NH3![]() Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。下列说法不正确的是
Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。下列说法不正确的是
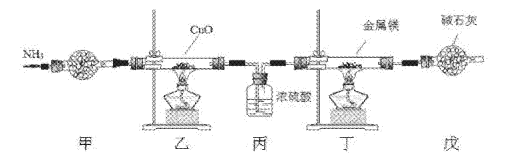
A. 实验开始时应先点燃乙处酒精灯,再点燃丁处酒精灯
B. 装置乙的目的是制备N2
C. 装置丙与装置戊可以对调
D. 取装置丁所得固体少许,滴入少量蒸馏水,可检验是否有Mg3N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:
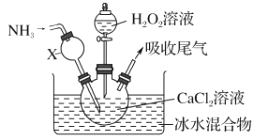
回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有_______________。
(2)仪器X的主要作用除导气外,还具有的作用是_________。
(3)在冰水浴中进行的原因是______________________。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为__________。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是_______。
a.无水乙醇 b.浓盐酸 c.Na2SO3溶液 d.CaCl2溶液
(6)过氧化钙(与过氧化钠性质相似)可用于长途运输鱼苗,这体现了过氧化钙具有_____的性质。
a.与水缓慢反应供氧 b.能吸收鱼苗呼出的CO2气体 c.能使水体酸性增强
(7)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。则所得过氧化钙样品中CaO2的纯度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计以下实验方案,从海带中提取I2。

(1)操作①的名称是______。
(2)向滤液中加入双氧水的作用是______。
(3)试剂a可以是______(填序号)。
①四氯化碳 ②苯 ③酒精 ④乙酸
(4)I–和IO3-在酸性条件下生成I2的离子方程式是________________。
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数的值,下列说法正确的是( )
①1mol金属钠加热时完全反应,转移电子数为NA
②标准状况下,22.4L水中分子数为NA
③1L2mo/L的氯化镁溶液中含氯离子数目为4NA
④0.5molFe与足量稀HCl反应时,转移的电子数为2NA
⑤46gNO2和N2O4混合气体中含有原子数为3NA
A. ①③④⑤ B. ③④ C. ①③⑤ D. ①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠被用作肉制品发色剂、防腐剂等,硝酸钠在肉制品加工中作发色剂。但亚硝酸钠是食品添加剂中急性毒性较强的物质之一,是一种剧毒药,摄取少量亚硝酸盐进入血液后,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。硝酸钠的毒性作用主要是由于它在食物中、在水中或在胃肠道内被还原成亚硝酸盐所致。亚硝酸钠生产方法是由硝酸生产过程中的氮氧化物气体![]() 、
、![]() 用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
![]() 实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到
实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到![]() 酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
![]() 写出氮氧化物
写出氮氧化物![]() 、
、![]() 与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用
与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用![]() 溶液吸收
溶液吸收![]() 可生成
可生成![]() ,
,![]() 和
和![]() 溶液完全反应时转移电子
溶液完全反应时转移电子![]() ,则反应的离子方程式为 ______ 。
,则反应的离子方程式为 ______ 。
![]() 从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
A.稀盐酸![]() 溶液
溶液![]() 稀硝酸
稀硝酸![]() 氢氧化钠溶液
氢氧化钠溶液
![]() 等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______
等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______ ![]() 填溶液中溶质的化学式
填溶液中溶质的化学式![]() 。
。
![]() 工业品硝酸钠含少量杂质
工业品硝酸钠含少量杂质![]() 、
、![]() 、NaCl、水不溶物
、NaCl、水不溶物![]() ,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
![]() 称取
称取![]() 干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL
干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL![]() 的A溶液
的A溶液![]() 足量
足量![]() ,充分反应后过滤;
,充分反应后过滤;
![]() 向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
![]() 取
取![]() 所配溶液于锥形瓶中,加入少量B物质,再用
所配溶液于锥形瓶中,加入少量B物质,再用![]() 的
的![]() 溶液滴定,用去
溶液滴定,用去![]() 溶液
溶液![]() 。
。
(有关反应为:![]()
![]() 溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
![]() 物质是 ______ ,滴定终点时的颜色变化是 ______ 。
物质是 ______ ,滴定终点时的颜色变化是 ______ 。
![]() 若该同学操作正确,但结果造成测定结果略偏高,其原因可能是
若该同学操作正确,但结果造成测定结果略偏高,其原因可能是![]() 任写一点
任写一点![]() ______ 。
______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com