
| A. | 原子半径:W>X>Z>Y | B. | 离子半径:Y>Z>X>W | ||
| C. | a+2=c-2 | D. | 热稳定性:H2Y>HZ |
分析 短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-2=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Mg元素,X为Na元素,
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大
B.电子层结构相同,核电荷数越大离子半径越小;
C.根据核外电子数目相等判断;
D.非金属性越强氢化物越稳定性.
解答 解:短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-2=b-1=c+2=d+1,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Mg元素,X为Na元素.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Mg>O>F,故A错误;
B.电子层结构相同,核电荷数越大离子半径越小,所以离子半径:O2->F->Na+>Mg2+,故B正确;
C.aW2+、cY2-核外电子数相同,故a-2=c+2,故C错误;
D.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为HF>H2O,故D错误;
故选B.
点评 本题考查结构与位置关系、元素周期律等,难度中等,根据电荷与核外电子排布相同推断元素在周期表中的位置是关键.


科目:高中化学 来源: 题型:选择题
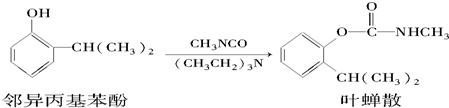
| A. | 叶蝉散的分子式是C11H16NO2 | |
| B. | 邻异丙基苯酚与FeCl3溶液反应生成蓝色沉淀 | |
| C. | 叶蝉散在强酸、强碱性环境中能稳定存在 | |
| D. | 可用FeCl3溶液检验叶蝉散中是否含邻异丙基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
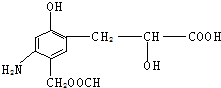 分析下列有机物的结构,判断该有机物可能发生的反应类型:( )
分析下列有机物的结构,判断该有机物可能发生的反应类型:( )| A. | 除④外其余都有 | B. | 全部 | C. | 只④⑤⑥⑦ | D. | 只①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇(结构简式如图所示),下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇(结构简式如图所示),下列有关芥子醇的说法正确的是( )| A. | 芥子醇分子式C11H12O4 | |
| B. | 芥子醇分子中所有原子可能在同一平面上 | |
| C. | 芥子醇与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 芥子醇能发生的反应类型有氧化、取代、加聚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
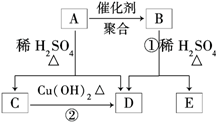 化合物A的相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧.A的相关反应如图所示:
化合物A的相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧.A的相关反应如图所示: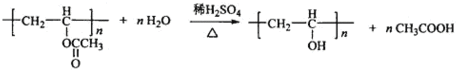 ;
; 、
、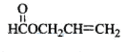 、
、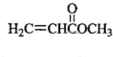 、
、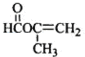 ;
;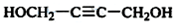 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H4--易燃液体 | B. | H2SO4、NaOH--腐蚀品 | ||
| C. | CaC2、Na--遇湿易燃物品 | D. | KMnO4、K2Cr2O7--氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com