
分析 (1)设初始加入容器的CH4的物质的量为x mol.
发生反应的化学方程式:CH4(g)+H2O(g)?CO(g)+3H2(g)
起始浓度/mol•L-1 x x 0 0
平衡浓度/mol•L-1 x-0.1 x-0.1 0.1 0.3
K=$\frac{c(CO)•c3(H2)}{c(CH4)•c(H2O)}$=$\frac{0.1×0.33}{(x-0.1)2}$=27,
整理可得:$\frac{0.01}{(x-0.1)}$=1,据此计算出x即可;
(2)平衡时消耗甲烷的物质的量为0.1mol,则CH4的转化率=$\frac{0.1mol}{0.11mol}$×100%,据此可计算出甲烷的转化率;
(3)加入0.01 mol H2O(g)和0.1 molCO时:Qc=$\frac{c(CO)•c3(H2)}{c(CH4)•c(H2O)}$=$\frac{0.2×0.33}{0.01×0.02}$=27=K,则平衡不移动.
解答 解:(1)设初始加入容器的CH4的物质的量为x mol.
发生反应的化学方程式:CH4(g)+H2O(g)?CO(g)+3H2(g)
起始浓度/mol•L-1 x x 0 0
转化浓度/mol•L-1 0.1 0.1 0.1 0.3
平衡浓度/mol•L-1 x-0.1 x-0.1 0.1 0.3
K=$\frac{c(CO)•c3(H2)}{c(CH4)•c(H2O)}$=$\frac{0.1×0.33}{(x-0.1)2}$=27,
整理可得:$\frac{0.01}{(x-0.1)}$=1,
解得:x=0.11,
答:初始加入容器的CH4的物质的量为0.11 mol;
(2)平衡时消耗甲烷的物质的量为0.1mol,则CH4的转化率=$\frac{0.1mol}{0.11mol}$×100%≈91%,
答:CH4的平衡转化率为91%;
(3)加入0.01 mol H2O(g)和0.1 molCO时:
Qc=$\frac{c(CO)•c3(H2)}{c(CH4)•c(H2O)}$=$\frac{0.2×0.33}{0.01×0.02}$=27=K,
所以平衡不移动,
答:再向上述平衡混合物中加入0.01 mol H2O(g)和0.1 mol CO,平衡不移动.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 2mol/L的Na2CO3溶液中Na+个数为4NA | |
| B. | 2L 0.5mol/LCH3COOH溶液中含有的H+数为NA | |
| C. | 含2mol溶质的浓硫酸与足量的Cu反应转移的电子数为2NA | |
| D. | 1L 2mol/L的K2CO3溶液中CO32-个数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
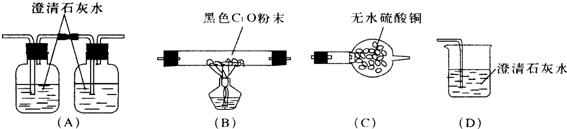
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验①所涉及的物质均为电解质 | |
| B. | 实验②、③得到的分散系中分散质粒子的直径:②>③ | |
| C. | 实验③得到的物质能产生丁达尔现象 | |
| D. | 实验③反应制得的物质为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸后,再做银镜反应实验或与新制Cu(OH)2共热的实验 | |
| C. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入稀硝酸酸化,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
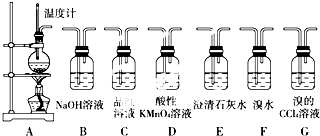
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于蒸发溶剂而析出晶体后的溶液仍为饱和溶液 | |
| B. | 在饱和溶液中,溶质的溶解速率等于结晶速率 | |
| C. | 任何物质的饱和溶液升高温度时,都变成不饱和溶液 | |
| D. | 溶质刚开始溶解时的溶液为不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
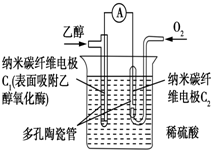
| A. | C1极为电池负极,C2极为电池正极 | |
| B. | 溶液中的H+向C1电极移动 | |
| C. | 该生物燃料电池的总反应方程式为C2H5OH+3O2═2CO2+3H2O | |
| D. | 电流由C2极经外电路流向C1极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com