
| A. | 此时水的转化率为71.4% | |
| B. | 此时CO2的体积分数为20.4% | |
| C. | 若再向容器内通入5mol H2O,则达到新平衡时,H2O的转化率升高 | |
| D. | 若从容器内移走5mol H2O,则达到新平衡时,CO的转化率升高 |
分析 在密闭容器中将CO和水蒸气的混合物加热到800℃时,达到平衡状态,设消耗一氧化碳物质的量为x:
CO+H2O?CO2+H2,
起始量(mol) 2 5 0 0
变化量(mol) x x x x
平衡量(mol)2-x 5-x x x
反应前后气体物质的量不变,可以利用气体物质的量代替平衡浓度计算平衡常数
平衡常数K=$\frac{{x}^{2}}{(2-x)(5-x)}$=1.
x=$\frac{10}{7}$,
结合浓度对平衡移动的影响解答该题.
解答 解:在密闭容器中将CO和水蒸气的混合物加热到800℃时,达到平衡状态,设消耗一氧化碳物质的量为x:
CO+H2O?CO2+H2,
起始量(mol) 2 5 0 0
变化量(mol) x x x x
平衡量(mol)2-x 5-x x x
反应前后气体物质的量不变,可以利用气体物质的量代替平衡浓度计算平衡常数
平衡常数K=$\frac{{x}^{2}}{(2-x)(5-x)}$=1.
x=$\frac{10}{7}$,
A.水的转化率为$\frac{\frac{10}{7}}{5}$×100%=28.6%,故A错误;
B.CO2的体积分数为$\frac{\frac{10}{7}}{7}$×100%=20.4%,故B正确;
C.加入水,虽然平衡正向移动,但转化的比加入的少,转化率反而降低,故C错误;
D.若从容器内移走5mol H2O,平衡逆向移动,则达到新平衡时,CO的转化率降低,故D错误.
故选B.
点评 本题考查了化学平衡计算方法的分析应用,为高考常见题型,侧重于学生的分析、计算能量的考查,题目主要是平衡常数概念的计算,题目较简单.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:解答题
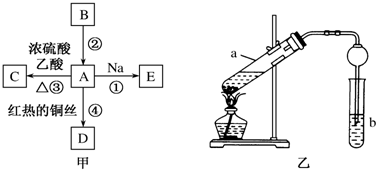
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可以和澄清石灰水反应制造漂白粉 | |
| B. | 金属钠可以用来冶炼某些金属 | |
| C. | 石灰石用于工业炼铁和玻璃制造 | |
| D. | 二氧化硅可以用于制作光学镜片,也可以制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
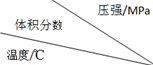 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 5个 | B. | 4个 | C. | 3个 | D. | 2个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其它条件相同时,在Ⅰ、Ⅱ中都分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态:2X(?)+Y(?)?aZ(g).此时Ⅰ中X、Y、Z的物质的量之比为1:3:2.下列判断不正确的是( )
如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其它条件相同时,在Ⅰ、Ⅱ中都分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态:2X(?)+Y(?)?aZ(g).此时Ⅰ中X、Y、Z的物质的量之比为1:3:2.下列判断不正确的是( )| A. | 物质Z的化学计量数a=1 | |
| B. | 若X、Y均为气态,则在平衡时X的转化率:Ⅰ>Ⅱ | |
| C. | 若Ⅱ中气体的密度变化如图Ⅲ所示,则X、Y中只有一种为气态 | |
| D. | 若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的平均反应速率为0.15mol/(L•min) | B. | B的转化率为20% | ||
| C. | B的平衡浓度为0.5mol/L | D. | x的数值为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
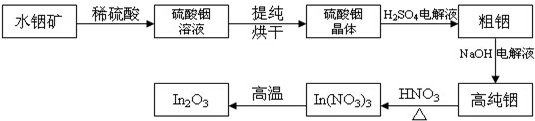
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
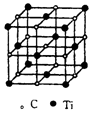 最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示.顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示.顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )| A. | TiC | B. | Ti6C7 | C. | Ti14C13 | D. | Ti13C14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com