
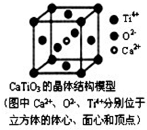
 下列关于晶体的说法正确的组合是( )
下列关于晶体的说法正确的组合是( )| A. | ①②③⑥ | B. | ①②④ | C. | ③⑤⑦ | D. | ③⑤⑧ |
分析 ①稀有气体为单原子分子;
②金属晶体由阳离子与自由电子构成;
③熔沸点轨道规律,一般是原子晶体>离子晶体>分子晶体,原子晶体中键长越长熔沸点越低,离子晶体中
根据离子半径对晶格能的影响判断,分子晶体结合氢键与分子间作用力判断;
④离子晶体中可能含有共价键;
⑤以顶点Ti4+离子研究,与之最近的O2-位于面心上,每个Ti4+离子为12个面共用;
⑥金刚石为原子晶体,硬度很大是因为金刚石的共价键很强;
⑦分子稳定性属于化学性质;
⑧氯化钠属于离子晶体,微粒之间作用为离子键.
解答 解:①稀有气体为单原子分子,不存在共价键,故①错误;
②晶体含有阴离子,则一定含有阳离子,但金属晶体由阳离子与自由电子构成,没有阴离子,故②错误;
③金刚石、SiC属于原子晶体,键长C-C<Si-C,故金刚石中化学键更稳定,其熔点更高,H2O、H2S都属于分子晶体,水分子之间存在氢键,熔点较高,熔点原子晶体>离子晶体>分子晶体,故金刚石、SiC、H2O、H2S晶体的熔点依次降低,故③正确;
④共价化合物一定不含离子键,但离子晶体中可能含有共价键,如氢氧化钠、过氧化钠、铵盐等,故④错误;
⑤以顶点Ti4+离子研究,与之最近的O2-位于面心上,每个Ti4+离子为12个面共用,故每个Ti4+和12个O2-相紧邻,故⑤正确;
⑥金刚石为原子晶体,硬度很大是因为金刚石的共价键很强,故⑥错误;
⑦分子间作用力影响物理性质,分子稳定性属于化学性质,故⑦错误;
⑧氯化钠属于离子晶体,微粒之间作用为离子键,熔化时破坏离子键,故⑧正确.
故选D.
点评 本题考查晶体结构与性质,涉及化学键、熔沸点比较、晶胞结构等,难度中等,注意掌握熔沸点比较规律,注意识记中学常见的晶胞结构.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
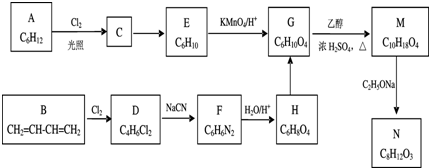
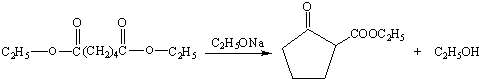
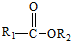 +
+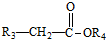 $\stackrel{C_{2}H_{5}ONa}{→}$
$\stackrel{C_{2}H_{5}ONa}{→}$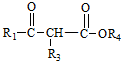 +R2OH
+R2OH .
. .
.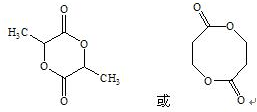 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.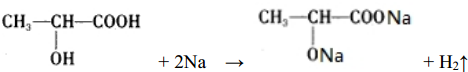 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
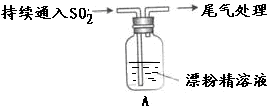 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
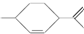 ,下列有关该有机物的说法中不正确的是( )
,下列有关该有机物的说法中不正确的是( )| A. | 分子式为C10H18 | |
| B. | 常温下呈液态,难溶于水 | |
| C. | 1 mol该有机物最多能和2mol H2发生加成反应 | |
| D. | 该有机物能与溴水发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向1 mol•L-1 AlCl3溶液中加过量的6 mol•L-1 NaOH溶液可制备Al(OH)3悬浊液 | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 向含有少量Fe3+的CuSO4溶液中加入铜片可除去Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2 | B. | NH3 | C. | H2O | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液 | |
| B. | 用重铬酸钾溶液检验司机是否酒驾所发生的反应属于乙醇的氧化反应 | |
| C. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| D. | 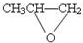 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应不符合绿色化学原则 ,该反应不符合绿色化学原则 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com