
下图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是( )
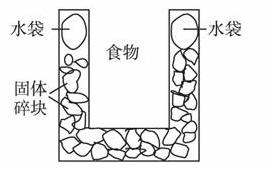
A.硝酸铵 B.生石灰 C.氯化镁 D.食盐
 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
下列说法中错误的是( )
|
| A. | 从1L 1mol•L﹣1的NaCl溶液中取出10mL,其浓度仍是1mol•L﹣1 |
|
| B. | 制成0.5L 10mol•L﹣1的盐酸,需标准状况下氯化氢气体112L |
|
| C. | 0.5L 2mol•L﹣1 BaCl2溶液中,Ba2+和Cl﹣总数为3×6.02×1023 |
|
| D. | 10g 98%硫酸(密度为1.84g•cm﹣3)与10mL 18.4 mol•L﹣1硫酸的浓度是不同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液加入CCl4,CC14层显紫色,证明原溶液中存在I−
D.某溶被加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8.nH2O)等化合物。
1)三硅酸镁的氧化物形式为 ,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为 。
2)铝元素的原子核外共有 种不同运动状态的电子、 种不同能级的电子。
3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径 (填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
4) Al2O3、MgO和SiO2都可以制耐火材料,其原因是 。
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下图),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是( )
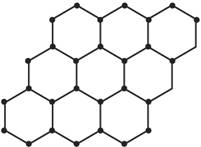
A.石墨烯与石墨互为同位素
B.0.12 g石墨烯中含6.02×1022个碳原子
C.石墨烯是一种有机物
D.石墨烯中碳原子间以共价键结合
查看答案和解析>>
科目:高中化学 来源: 题型:
磷单质及其化合物有广泛应用。
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来___________________________________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)====6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)====P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)====CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=_____________________________。
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见下图)之间脱去两个水分子的产物,其结构式为________________________。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为___________________________。

(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为________________________。
②化学镀镍的溶液中含有Ni2+和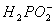 ,在酸性等条件下发生下述反应:
,在酸性等条件下发生下述反应:
(a)__________Ni2++__________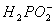 +__________
+__________ __________Ni+________
__________Ni+________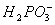 +_______
+_______
(b)6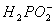 +2H+====2P+4
+2H+====2P+4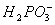 +3H2↑
+3H2↑
请在答题卡上写出并配平反应式(a)。
③利用②中反应可在塑料镀件表面沉积镍磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点:_______________;原理上的相同点:_______________;化学镀的优点:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Cl、N、S等非金属元素化合物的说法正确的是…( )
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+_____KI+_____H2SO4====_____K2SO4+_____I2+______H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_______________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________________。
(3)已知:I2+2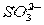 ====2I-+
====2I-+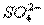 。
。
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________________。
②b中反应所产生的I2的物质的量是______________________________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
______________________________mg/kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com