
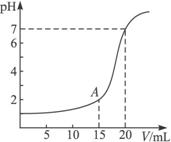
(1)氢氧化钠物质的量浓度是多少?
(2)A点时溶液的pH是多少?
解析:(1)根据题给图象可以看出,在氢氧化钠的体积为0时,盐酸溶液的pH=1,故可求出盐酸溶液的物质的量浓度为0.1 mol·L-1;再根据pH=7时,用去氢氧化钠的体积为20 mL,此时盐酸与氧氧化钠恰好完全反应,则有
(2)A点时,显然盐酸是过量的,则加入的氢氧化钠与盐酸反应后剩余的盐酸为
c(H+)=![]() =1×10-2 mol·L-1,所以,pH=2。
=1×10-2 mol·L-1,所以,pH=2。
答案:(1)0.05 mol·L-1 (2)2


 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:阅读理解
| 难溶电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸。
有关离子方程式为:4![]() +5HCHO+H+
+5HCHO+H+![]() 4Mn2++5CO2↑+11H2O
4Mn2++5CO2↑+11H2O
2![]() +5H
+5H![]() 2Mn2++10CO2 ↑+8H2O
2Mn2++10CO2 ↑+8H2O
测定装置:部分装置如下图所示(a、b为止水夹)

测定步骤:
①收集待检新装修的房屋居室空气
②准确量取5.00 mL 1.00×10-3 mol·L-1的高锰酸钾溶液于250 mL锥形瓶中,滴入3滴6 mol·L-1的H2SO4溶液,加水45 mL稀释备用。
③将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的房屋的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入高锰酸钾酸性溶液中,使其充分反应。再如此重复4次。
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积。
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00 mL)。3次实验所消耗草酸溶液的体积平均值为12.38 mL。
完成以下问题:
(1)使用________量取5.00 mL高锰酸钾溶液。
(2)如果注射器压送气体速度过快,可能会产生什么不良后果?
___________________________。
(3)本实验是否需要外加指示剂?若需要,请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。
___________________________。
(4)计算该居室内空气中甲醛的浓度_________mg·m-3,该居室的甲醛_________(填“是”或“否”)超标。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省蚌埠市高二第二学期期中联考试化学试卷(带解析) 题型:填空题
10分)如下图所示装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答:
(1)a为 极
(2)电解开始时,在B烧杯的中央滴几滴淀粉溶液,你能观察到的现象是 ;电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为: 。
(3)当d电极上收集到44.8 ml气体(标准状况)时停止电解,a极上放出了 ml气体,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为 g·moL-1。
查看答案和解析>>
科目:高中化学 来源:2011届江苏省淮安市高三第四次调研测试化学试卷 题型:填空题
(12分)MnSO4·H2O在工业、农业等方面有广泛的应用。
(一)制备:工业上用化工厂尾气中低浓度SO2还原MnO2矿制备MnSO4·H2O过程如下: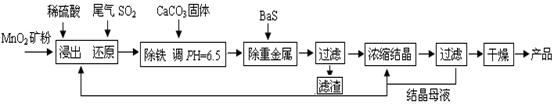
已知:常温时部分硫化物难溶盐的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、
MnS--2.5×10-10,请回答下列问题:
(1)生产中MnO2矿粉碎的目的是 ▲ 。
(2)除铁发生的离子反应方程式为 ▲ 。
(3)除重金属离子后,若混合溶液中Cu2+、Pb2+、Ni2+的浓度均为1.0×10-5mol/L,则c(S2-)最大= ▲ mol/L。
(二):性质—热稳定性:MnSO4·H2O在1150℃高温下分解 的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是 ▲
的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是 ▲
(三)废水处理:工厂废水中主要污染为Mn2+和Cr6+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,(1)取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示。则在pH一定时,废水中铁屑用量为 ▲ 时锰、铬去除率最好
(2)取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图2所示。则在铁屑用量一定时,废水pH= ▲ 时锰、铬去除率最好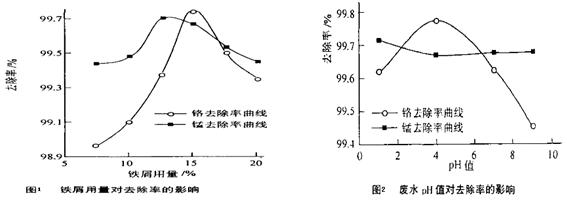
查看答案和解析>>
科目:高中化学 来源:2014届河北省高一下学期三调考试化学试卷(解析版) 题型:填空题
(8分)已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的组成元素的离子半径是第三周期元素中离子半径最小的。N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为气体单质,D为无色气体,在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。
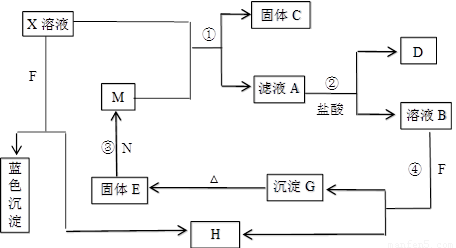
请回答下列问题:
(1)X的化学式为 ;F的电子式为 。
(2)反应②的离子方程式为_______________________________________________。
反应③的化学方程式为_______________________________________________。
(3)若向100 mL 盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干
得10.16g固体C。则滤液A中溶质的物质的量浓度为________________________。(假设体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com