
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 150 | 300 | 380 | 410 |
分析 (1)影响化学反应速率的因素有浓度、温度以及固体的表面积大小等因素,温度越高、浓度越大、固体表面积越大,反应的速率越大,从表中数据看出2 min~3 min收集的氢气比其他时间段多,原因是Zn置换H2的反应是放热反应,温度升高;4 min~5 min收集的氢气最少是因为随反应进行c(H+)下降;
(2)影响反应速率的因素:浓度、原电池原理、温度、压强等,据此回答判断;
(3)根据原子最外层电子数和化合价判断,在化合物中,原子最外层电子数等于原子的价层电子数+|化合价|,以此进行分析.
解答 解:(1)①0~1、l~2、2~3、3~4、4~5min各时间段生成氢气的体积分别为50、150、300、380、410,可以看出反应速率最大的是2~3min,锌与稀硫酸反应为放热反应,随反应的进行,温度越来越高,反应速率加快,
故答案为:2~3min;因该反应是放热反应,此时温度高;
②4 min~5 min收集的氢气最少是因为随反应进行c(H+)下降,反应物浓度越低,反应速率越小,
故答案为:4~5 min,此时H+浓度小;
(2)为了减慢反应速率,可以降低反应温度、减低反应物的浓度,加入蒸馏水可以扩大酸溶液的体积而降低其浓度,加入硝酸钠溶液时,存在的硝酸根离子和氢离子相当于存在硝酸,金属铝和硝酸反应不会产生氢气,当加入少量CuCl2晶体时,CuCl2会与锌反应置换出铜,Al、铜与酸会形成原电池,发生原电池反应而加快反应速率,
故答案为:A;BC;加入少量CuCl2晶体时,CuCl2会与锌反应置换出铜,Al、铜与酸会形成原电池,发生原电池反应而加快反应速率;加入硝酸钠溶液时,存在的硝酸根离子和氢离子相当于存在硝酸,金属铝和硝酸反应不会产生氢气;
(3)根据原子最外层电子数和化合价判断,在化合物中,原子最外层电子数等于原子的价层电子数+|化合价|,
①H2O中的H原子不满足最外层为8电子结构,故错误;
②BF3B原不满足最外层为8电子结构,故错误;
③CCl4原子都满足最外层为8电子结构,故正确;
④PCl3原子都满足最外层为8电子结构,故正确;
⑤SO3S原子不满足最外层为8电子结构,故错误;
⑥N2满足最外层为8电子结构,故正确;
⑦CO2原子都满足最外层为8电子结构,故正确;
故答案为:③④⑥⑦.
点评 本题考查化学反应速率的影响因素,题目难度不大,注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,注重基础知识的积累.


科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L NH3溶于水后溶液中含有NA个NH4+ | |
| B. | 1L 0.1 mol•L-1的Na2CO3溶液中含有0.2 NA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液中含有0.1NAFe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH在水中显碱性 | |
| B. | NaH中氢离子电子层排布与氦原子相同 | |
| C. | NaH中氢离子半径比锂离子半径大 | |
| D. | NaH中氢离子被还原为H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使反应速率增大的主要原因是减小了反应物分子中活化分子的百分数 | |
| D. | 催化剂能增大活化分子的百分数,从而成千上万倍地增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
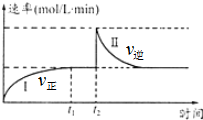 在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(
在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(| A. | 0~t2时,v正>v逆 | |
| B. | t2时刻改变的条件可能是加催化剂 | |
| C. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数I<Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W 元素的离子半径依次减小 | |
| B. | W 的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| C. | 若W 与Y的原子序数相差5,则二者形成的化合物的化学式可能为Y2W3或Y3W2 | |
| D. | W 与X形成的化合物只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | R原子最外层电子数为5 | B. | 单质的氧化性:甲<乙 | ||
| C. | 原子半径:R>Z | D. | HRO3与HZ计量数之比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z) | |
| B. | 气态氢化物的热稳定性:X>Y | |
| C. | 元素X的最高价氧化物对应的水化物是强酸 | |
| D. | 化合物XY、Z2Y、Z2Y2中化学键的类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com