
【题目】请根据电解饱和食盐水的实验内容填写:
(1) 阳极与电源的__极(选填正或负)相连;阳极产生_(填化学式)气体;它的检验方法是__。
(2)阳极发生___反应;阴极发生__反应(选填氧化或还原)。
【答案】阳 氯气 湿润的淀粉碘化钾试纸变蓝 氧化 还原
【解析】
饱和食盐水中含有大量的Na+和Cl-,还有少量的H+和OH-;在外加电流的作用下可以发生电解反应。根据放电顺序,阳极上Cl-要先与OH-失电子,Cl-失电子生成Cl2,阴极上H+得电子生成H2,此时溶液中剩余Na+和OH-。因此,在电解过程中阳极的电极方程式为2Cl--2e-=Cl2↑,阴极的电极方程式为2H++2e-=H2↑,电解过程的总反应为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,据此回答。
2NaOH+H2↑+Cl2↑,据此回答。
(1)电解过程中电源的正极与电解池的阳极相连,电源的负极与电解池的阴极相连;根据分析阳极产生氯气,可用湿润的淀粉碘化钾试纸检验,在氯气的作用下,碘离子被还原为碘单质,使试纸变蓝,故检验氯气的现象为湿润的淀粉碘化钾试纸变蓝;
(2)阳极上发生失电子的反应,为氧化反应;阴极上发生得电子的反应,为还原反应。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】某同学为验证同主族元素非金属性的变化规律,设计了如下实验(实验装置如图所示)。
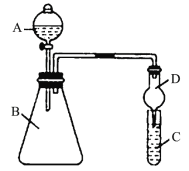
(1)仪器A的名称为___,干燥管D的作用是___。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为___。
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4固体,C中加淀粉碘化钾混合溶液,观察到___,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用___溶液吸收尾气。
(4)课外活动小组在A中加盐酸、B中加CaCO3固体,C中加Na2SiO3溶液,观察到C中产生白色沉淀(H2SiO3),请你利用原子结构知识解释这一现象:___;有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加盛有___的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动汽车已逐渐走入人们的生活,一些电动汽车动力使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A极材料是金属锂和石墨的复合材料(石墨作为金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过,电池反应式为LixC6+Li1xCoO2![]() C6+LiCoO2,下列说法不正确的是
C6+LiCoO2,下列说法不正确的是
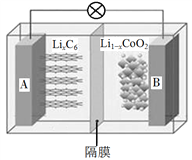
A. 该隔膜只允许Li+通过,放电时Li+从左边移向右边
B. 充电时,B电极与电源正极相连
C. 电池放电时,负极的电极反应式为LixC6xe![]() xLi++C6
xLi++C6
D. 废旧钴酸锂电池进行“放电处理”让Li+进入石墨中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:
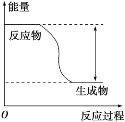
(1)该反应为_____(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率加快,下列措施可行的是_____(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_____(填“正”或“负”)极。铜片上的现象为_____,该极上发生的电极反应为_____,外电路中电子由_____移动。(填“正极向负极”或“负极向正极”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,有下列五种溶液:
①0.1mol/LNH4Cl②0.1mol/LCH3COONH4③0.1mol/LNH4HSO4
④0.1mol/LNH4HCO3 ⑤0.1mol/LNaHCO3
请根据要求填写下列空白:
(1)溶液①呈 ______ 性(填“酸”、“碱”或“中”),其原因是: ______ (用离子方程式表示)
(2)溶液⑤呈 ______ 性(填“酸”、“碱”或“中”),其原因是: ______ (用离子方程式表示)
(3)比较溶液①、③中c(NH4+)的大小关系是① ______ ③(填“>”、“<”或“=”)
(4)常温下,测得溶液②的pH=7,则CH3COO-的水解程度 ______ NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____c(NH4+)(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
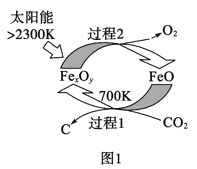
【题目】二氧化碳的利用是我国能源领域的一个重要战略方向,目前我国科学家在以下方面已经取得重大成果。
(1)图1是由CO2制取C的太阳能工艺。已知过程1发生的反应中![]() =6,则FexOy的化学式为__。过程1生成1molC的反应热为△H1;过程2产生lmolO2(g)的反应热为△H2。则由CO2制取C的热化学方程式为__。
=6,则FexOy的化学式为__。过程1生成1molC的反应热为△H1;过程2产生lmolO2(g)的反应热为△H2。则由CO2制取C的热化学方程式为__。
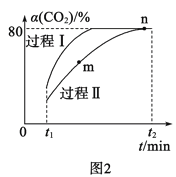
(2)利用CO2合成甲醇的反应为:CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定条件下,将1molCO2和2.8molH2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图2所示。过程Ⅰ的活化能__(填“>”“<”或“=”)过程Ⅱ的活化能,n点的平衡常数K=__。
H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定条件下,将1molCO2和2.8molH2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图2所示。过程Ⅰ的活化能__(填“>”“<”或“=”)过程Ⅱ的活化能,n点的平衡常数K=__。
(3)用二氧化碳合成低密度聚乙烯(LDPE)。以纳米二氧化钛膜为工作电极,常温常压电解CO2,可制得LDPE,该电极反应可能的机理如图3所示。
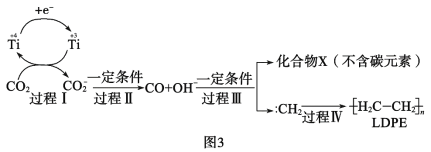
①过程Ⅰ~Ⅲ中碳元素发生__反应(填“氧化”或“还原”)。
②请补充完整并配平CO2转化为LDPE的电极反应:2nCO2+___+___=![]() +___。__
+___。__
③工业上生产1.4×104g的LDPE,理论上需要标准状况下CO2的体积是__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,不属于四种基本反应类型的是( )
A.2HCl+CaCO3=CaCl2+H2O+CO2↑B.2FeCl3+Cu=2FeCl2+CuCl2
C.2KMnO4![]() K2MnO4+MnO2+O2↑D.Na2O+H2O=2NaOH
K2MnO4+MnO2+O2↑D.Na2O+H2O=2NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,M为铁棒,N为石墨棒。关于此装置的下列叙述中,不正确的是( )
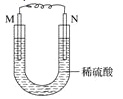
A.M为负极,N为正极
B.N上发生的反应为2H++2e=H2↑
C.M上发生的反应为Fe-3e-=Fe3+
D.溶液中的硫酸根离子向M移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com