
����Ŀ��������ѧ֪ʶ������������⣺
��1��AgNO3��ˮ��Һ��______�����������������������������ԣ�ԭ���ǣ������ӷ���ʽ��ʾ����_____��ʵ����������AgNO3����Һʱ������AgNO3���������ڽ�Ũ�������У�Ȼ����������ˮϡ�͵������Ũ�ȣ�Ŀ����______��
��2�����г�����������Һ��NH4Cl��Һ CH3COONa��Һ (NH4)2SO4��Һ NH4HSO4��Һ NaOH��Һ
��NH4Cl��Һ��pH_____7�����������������������������������¶ȿ���_______�������ٽ���������������NH4Cl��ˮ�⣻
��pH��ȵ�NaOH��Һ��CH3COONa��Һ���ֱ���ȵ���ͬ���¶Ⱥ�CH3COONa��Һ��pH_______NaOH��Һ��pH����������������������������
��Ũ����ͬ������������Һ����A��NH4Cl��Һ(B) (NH4)2SO4��Һ(C)NH4HSO4 ��Һ����c(NH4+)�ɴ�С��˳��Ϊ____��___��____���������գ���
��3������AlCl3��Һ���ܵõ���ˮAlCl3��ʹSOCl2��AlCl3��6H2O��ϲ����ȣ��ɵõ���ˮAlCl3���Խ���ԭ��________�� ����ʾ��SOCl2��ˮ��Ӧ�Ļ�ѧ����ʽΪSOCl2 +H2O= SO2��+ 2HCl����
���𰸡��� Ag�� �� H2O ![]() AgOH �� H�� ����Ag��ˮ�� �� �ٽ� �� B C A Al3+ +3H2O
AgOH �� H�� ����Ag��ˮ�� �� �ٽ� �� B C A Al3+ +3H2O ![]() Al(OH)3+3H+��AlCl3��6 H2O��SOCl2��ϼ��ȣ� SOCl2��AlCl3��6 H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬����AlCl3ˮ��
Al(OH)3+3H+��AlCl3��6 H2O��SOCl2��ϼ��ȣ� SOCl2��AlCl3��6 H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬����AlCl3ˮ��
��������
(1)��������ǿ�������Σ�ˮ��Һ��������ˮ�������ԣ�������������Һ��������������������ˮ�⣻
(2)��ǿ������������Һ��ˮ�⣬��Һ�����ԣ������¶ȴٽ��ε�ˮ�⣻
����������Ϊǿ����Һ��������Ϊǿ�������Σ����Ⱥ�����������Һ��pH�������䣬�������Ƶ�ˮ��̶�������ҺpH����
��Ũ����ͬʱ������淋Ļ�ѧʽ�к�������笠����ӣ�����Һ�к���笠�����Ũ���������������������������笠����ӵ�ˮ��Ƚ�笠�����Ũ�ȴ�С��
(3)SOCl2��AlCl36H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬�������Ȼ�����ˮ�⡣
(1)��������ǿ�������Σ�ˮ��Һ��������ˮ�������ԣ���Ӧ�����ӷ���ʽΪ��Ag++H2OAgOH+H+��ʵ����������AgNO3����Һʱ������AgNO3���������ڽ�Ũ�������У�Ȼ����������ˮϡ�͵������Ũ�ȣ����м�������Ŀ��������������ˮ�⣬������Һ����ǣ�
(2)��NH4ClΪǿ�������Σ�笠���������Һ��ˮ�⣬��Һ�����ԣ���Һ��pH��7���ε�ˮ��Ϊ���ȷ�Ӧ�������¶ȴٽ�NH4Cl��ˮ�⣻
��pH��ȵ�NaOH��Һ��CH3COONa��Һ��������Ϊǿ�������Σ����������ˮ����Һ��ʾ���ԣ����Ⱥ��������ӵ�ˮ��̶���������ҺpH�������Էֱ���ȵ���ͬ���¶Ⱥ�CH3COONa��Һ��pH��NaOH��Һ��pH��
��Ũ����ͬ������������Һ��(A)NH4Cl��Һ��(B)(NH4)2SO4��Һ��(C)NH4HSO4��Һ��B�Ļ�ѧʽ�к�������笠����ӣ�����Һ��c(NH4+)���NH4HSO4�������������������笠����ӵ�ˮ�⣬��C��Һ��笠�����Ũ�ȴ���A������������Һ��c(NH4+)�ɴ�С��˳��Ϊ��B��C��A��
(3)����HCl�ӷ�������AlCl3��Һ���ܵõ���ˮAlCl3����ʹSOCl2��AlCl36H2O��ϲ����ȣ�SOCl2��ˮ��Ӧ���ɵ��Ȼ������Ȼ���ˮ�����������ã��ɵõ���ˮAlCl3���ʴ�Ϊ��Al3++3H2OAl(OH)3+3H+��AlCl36H2O��SOCl2��ϼ��ȣ�SOCl2��AlCl36H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬����AlCl3ˮ�⡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
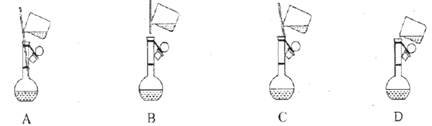
����Ŀ���屽�Dz�����ˮ��Һ�壬�����²����ᡢ�Ӧ��������ͼװ����ȡ���÷�Ӧ�ų�����������ȡʱ�۲쵽��ƿ�е��ܿ��а������ֵ���������˵���������

A. �Ʊ��屽�ķ�Ӧ����ȡ����Ӧ
B. װ��ͼ�г�ֱ�������ܽ���������
C. �÷�Ӧ�����ܿ�����ƿ���к�ɫ����
D. �屽�������������壬����NaOH��Һϴ�ӳ�ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ��֤SO2�Ļ�ԭ�Ժ�Fe3+�������ԣ��������������̽�����
I.����Ԥ��
����ȤС��ʵ��ʵʩǰ�����˳�ֵ����۽���,ȷ��ѡ��SO2��FeCl3��Һ�ķ�Ӧ��̽������Ԥ�⽫SO2ͨ��FeCl3��Һ�е�����С��ͬѧ���������
��1��ȷ��ѡ��SO2��FeCl3��Һ�ķ�Ӧ����ѡ��SO2��Fe(NO3)3��Һ�ķ�Ӧ��̽��������Ϊ�����ǻ���ʲôԭ��������ѡ��_______________________________________��
��2����SO2ͨ��FeCl3��Һ�У�����Ϊ���ܹ۲쵽�������ǣ�______________________����Ԥ������������ǣ������ӷ���ʽ��ʾ����___________________________________��
II.ʵ��̽��
��1������1mol��L-1FeCl3��Һ��δ�������ữ��
��������С����λͬѧ��������Һʱ�ġ�ת�ơ�������������ȷ���ǣ�_________��
�ڼ���֪��Һ�����ԣ���ԭ���ǣ�___________________________�������ӷ���ʽ��ʾ����
��2����SO2ͨ��FeCl3��Һ�����ͣ��۲쵽��Һ���ػ�ɫ��Ϊ����ɫ����û�й۲쵽Ԥ�ڵ�������Ӧ�����Һ����12Сʱ���ֳ�����Ԥ�ڵĽ����
�������ϵ�֪��[Fe(HSO3)]2+Ϊ����ɫ������[Fe(HSO3)]2+�ķ�ӦΪ���淴Ӧ�������û�ѧ����ʽ���ͽ�SO2ͨ��FeCl3��Һ������ʱ�۲쵽������_____________________________________��
��3��Ϊ��̽��������̺���ɫ��ΪԤ����ɫ��ʱ�䣬С�����̽������ȡ����FeCl3��Һ����ͨ��SO2����Һ��Ϊ����ɫ����ŨHCl�ữ�������Ӻ��ΪԤ����ɫ�������Ʋ�С����ʵ�鷽������С���ŨHCl�ữ����Ŀ���ǣ�_____________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaCl�����������бز����ٵ����ʡ���NaCl����ˮ���1 mol��L-1����Һ���ܽ������ͼ��ʾ������˵����ȷ����

A. a����ΪNa+
B. ��Һ�к���NA��Na+
C. ˮ��b���ӵ�ͼʾ����ѧ
D. �����²ⶨ��NaCl��Һ��pHС��7��������Cl-ˮ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Na2CO3��NaHCO3��˵������ȷ���ǣ� ��
A.���ȶ��ԣ�Na2CO3��NaHCO3
B.���ԣ�Na2CO3��NaHCO3
C.ˮ�е��ܽ�ȣ�Na2CO3��NaHCO3
D.�����ᷴӦ�ٶ�Na2CO3��NaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ����Ǧ���أ���ŵ�ʱ��ԭ��ط�Ӧ��![]() ���ݴ˷�Ӧ�жϣ�������������ȷ����
���ݴ˷�Ӧ�жϣ�������������ȷ����![]() ����
����![]()
A. Pb������
B. ![]() �õ��ӣ�������
�õ��ӣ�������
C. ��طŵ�ʱ����Һ��������ǿ
D. ������Ӧ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С��ͨ��ʵ��̽��NO�ܷ���Na2O2��Ӧ�Լ���Ӧ��IJ����СС��ͬѧ�������ͼ��ʾװ��(�г������������õ��齺�ܾ���ʡ��)��

����������֪:��NO�Dz������������2NO2+2NaOH =NaNO3+NaNO2+H2O��
�ش��������⣺
��1��д��ľ̿��Ũ���ᷴӦ�Ļ�ѧ����ʽ��________________��
��2��Ϊ�����ʵ�飬ѡ����ͼ�е�װ�ã�������˳��Ϊa��_______(������������Сд��ĸ��ʾ)����ͬѧ��Ϊ��װ�ô���ȱ�ݣ����ȱ����______________��
��3�����Ӻ�������_____________��װ��ҩƷ��Ҫͨ��һ��ʱ��ĵ������ڵ���Ũ���ᣬ��ȼ�ƾ��ƣ�ͨ�뵪������ҪĿ����_______________��
��4��װ��E��������________________����˵��NO��Na2O2������Ӧ��ʵ��������_____________��
��5��̽��NO��Na2O2��Ӧ�IJ��
����1������ֻ��NaNO3������2��_________________��
����3������ΪNaNO3��NaNO2�Ļ���
Ϊ��֤��Ӧ�����С��ͬѧȷ��ȡ��Ӧ��Ĺ���3.50g������в���ȴ�������ˮ���100.00mL��Һ��ȡ10.00mL��Һ����ƿ�У���0.1000mol��L-1KMnO4��Һ(�����ữ)�ζ���������KMnO4��Һ20mL���ζ������з�����Ӧ�����ӷ���ʽΪ___________________����Ӧ������NaNO2����������Ϊ_____(������λ��Ч����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ����2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ��H=��2600 kJ/mol
4CO2(g)+2H2O(l) ��H=��2600 kJ/mol
��2CO(g)+O2(g)![]() 2CO2(g) ��H=��566 kJ/mol
2CO2(g) ��H=��566 kJ/mol
��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H=��49.0 kJ/mol
CH3OH(g)+H2O(g) ��H=��49.0 kJ/mol
����������ȷ����
A. ���ݷ���ʽ����CO��ȼ����Ϊ566 kJ/mol
B. �ڢ۷�Ӧʱ�����������������ʹ��H��С
C. ��Ͷ��1molCO2��3molH2��һ�������³�ַ�Ӧ����ų�����49.0 kJ
D. ��������ͬ������CO2����ų�������C2H2����CO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.ijͬѧ�����ͼ��ʾװ��̽�������ܷ���ˮ������Ӧ������a����Ҫ�ɷ��Ǻ�������ˮ��������������ش��������⣺
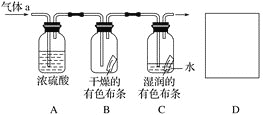
(1) Ũ�����������_____________________________��
(2) ֤��������ˮ������Ӧ��ʵ������Ϊ_________________________��
(3) ��ʵ����ƴ��ڵ�ȱ����____________________��Ϊ�˿˷���ȱ�ݣ���Ҫ����װ��D�����з�����Ӧ�����ӷ���ʽΪ_________________________��
II.��ͼΪŨ������ͭ��Ӧ�����������ʵ��װ��
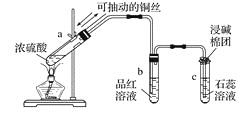
�ش��������⣺
(1) ָ���Թ�b��c�в�����ʵ������b��___________________��c��______________________��
(2) ��Ӧ�������Թ�a���в��ְ�ɫ���壬��a�Թ��е���Һ��������ˮ�У������ı仯��___________��
(3) д��Ũ������ͭ��Ӧ�Ļ�ѧ����ʽ��_____________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com