
【题目】2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸。发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云。根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等。运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是__________(填元素符号),解释原因_____________________________________________
(2)二甲基二硫和甲酸中,在水中溶解度较大的是 (填名称),原因是_______;烧碱所属的晶体类型为______;硫化碱(Na2S)的S2-的基态电子排布式是____________。
(3)硝酸铵中,NO3-的立体构型为 ,中心原子的杂化轨道类型为__________
(4)1mol化合物NaCN中CN-所含的π键数为______,与CN-互为等电子体的分子有 。(CN)2又称为拟卤素,实验室可以用氰化钠、二氧化锰和浓硫酸在加热条件下制得,写成该制备的化学方程式___________。
(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________;晶胞中K 原子的配位数为 ;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 ________(列出计算式,不需要计算出结果)。

【答案】(1)N;同周期元素第一电离能自左而右呈增大趋势,同主族自上而下元素第一电离能逐渐减小,但N原子的2p能级为半满稳定状态,第一电离能高于氧元素,故第一电离能最大的是N元素
(2)甲酸;甲酸与水形成氢键,而二甲基二硫与水分子间只有范德华力;离子晶体;1s2s22p63s23p6
(3)平面三角形;sp2
(4)2NA;CO或N2;2NaCN+MnO2+2H2SO4(浓)![]() (CN)2+Na2SO4+MnSO4+2H2O
(CN)2+Na2SO4+MnSO4+2H2O
(5)KNa3(或Na3K);6;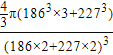 ×100%(或其他合理答案均可)
×100%(或其他合理答案均可)
【解析】
试题分析:(1)同周期元素第一电离能自左而右呈增大趋势,同主族自上而下元素第一电离能逐渐减小,但N原子的2p能级为半满稳定状态,第一电离能高于氧元素的,故NH4NO3、NaCN两种物质的元素中第一电离能最大的是N。
故答案为:N;同周期元素第一电离能自左而右呈增大趋势,同主族自上而下元素第一电离能逐渐减小,但N原子的2p能级为半满稳定状态,第一电离能高于氧元素,故第一电离能最大的是N元素;
(2)甲酸与水形成氢键,而二甲基二硫不能,二甲基二硫与水分子间只有范德华力,故二甲基二硫和甲酸中溶解度较大的是甲酸;烧碱由钠离子和氢氧根构成,所以烧碱是离子晶体,S2-离子核外有18个电子,其基态电子排布式为1s2s22p63s23p6。
故答案为:甲酸;甲酸与水形成氢键,而二甲基二硫与水分子间只有范德华力;离子晶体;1s2s22p63s23p6;
(3)NO3-离子中氮原子的孤电子对数=![]() =0,价层电子对数=3+0=3,所以NO3-立体构型为平面三角形,中心原子氮原子的杂化轨道类型sp2。
=0,价层电子对数=3+0=3,所以NO3-立体构型为平面三角形,中心原子氮原子的杂化轨道类型sp2。
故答案为:平面三角形;sp2;
(4)原子序数相等、价电子总数也相等的微粒互为电子,CN-与N2互为等电子体,二者结构相似,CN-中含有C≡N三键,三键中含有1个σ键、2个π键数,所以1mol化合物NaCN中CN-所含的π键数为2NA,CN-中含有两个原子、10个价电子,与CN-互为等电子体的分子有CO、N2,
根据制取氯气的反应可知,氰化钠、二氧化锰和浓硫酸在加热条件下制得(CN)2,反应化学方程式为:2NaCN+MnO2+2H2SO4(浓)![]() (CN)2+Na2SO4+MnSO4+2H2O。
(CN)2+Na2SO4+MnSO4+2H2O。
故答案为:2NA;CO或N2;2NaCN+MnO2+2H2SO4(浓)![]() (CN)2+Na2SO4+MnSO4+2H2O;
(CN)2+Na2SO4+MnSO4+2H2O;
(5)晶胞中,钠原子数为12×![]() =3,钾原子数为8×
=3,钾原子数为8×![]() =1,所以合金的化学式为KNa3,
=1,所以合金的化学式为KNa3,
根据晶胞图可知,每个K 原子周围有6个钠原子,所以晶胞中K 原子的配位数为6,
晶胞中钠原子和钾原子体积之和为![]() π[(186pm)3×3+(227pm)3],晶胞的边长为钠原子和钾原子的直径之和为2×(186pm+227pm),所以晶胞的体积为(2×186pm+2×227pm)3,晶体的空间利用率为
π[(186pm)3×3+(227pm)3],晶胞的边长为钠原子和钾原子的直径之和为2×(186pm+227pm),所以晶胞的体积为(2×186pm+2×227pm)3,晶体的空间利用率为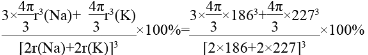 =
=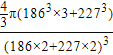 ×100%。
×100%。
故答案为:KNa3(或Na3K);6;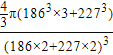 ×100%(或其他合理答案均可)。
×100%(或其他合理答案均可)。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】下列各组仪器:①集气瓶②漏斗③分液漏斗④容量瓶⑤托盘天平⑥胶头滴管⑦蒸馏烧瓶⑧量筒。其中常用于物质分离的有
A.②③⑦B.②⑥⑦C.①④⑧D.④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的部分,下列说法不正确的是

A. 元素最高化合价:F>S>P B. 酸性强弱:H2SO4>H3PO4
C. 非金属性F>S>P D. 最外层电子数:F>S>P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2 , 化学方程式如下:2NO+2CO2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)/molL﹣1 | 1.00×10﹣3 | 4.50×10﹣4 | 2.50×10﹣4 | 1.50×10﹣4 | 1.00×10﹣4 | 1.00×10﹣4 |
C(CO)/molL﹣1 | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | 2.70×10﹣3 | 2.70×10﹣3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)若1molNO和1molCO的总能量比1molCO2和0.5molN2的总能量大,则上述反应的△H0(填写“>”、“<”、“=”.)
(2)前2s内的平均反应速率v(N2)= .
(3)计算4s时NO的转化率 .
(4)下列措施能提高NO和CO转变成CO2和N2的反应速率的是 .
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
实验编号 | T/℃ | NO初始浓度/molL﹣1 | CO初始浓度/molL﹣1 | 催化剂的比表面积/m2g﹣1 |
Ⅰ | 280 | 1.20×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 124 | |||
Ⅲ | 350 | 124 |
①请在上表格中填入剩余的实验条件数据.
②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图表中a、b、c表示对应装置的仪器中加入的试剂,可制取、净化、收集的气体是
选项 | a | b | c | 气体 | 装置 |
A | 浓氨水 | 生石灰 | 浓硫酸 | NH3 |
|
B | 浓H2SO4 | 铜屑 | NaOH溶液 | SO2 | |
C | 稀HNO3 | 铜屑 | H2O | NO | |
D | 稀盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | CO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知450℃时,反应H2(g)+I2(g) ![]() 2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g) ![]() H2(g)+I2(g)的化学平衡常数为( )
H2(g)+I2(g)的化学平衡常数为( )
A.50
B.0.02
C.100
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如右图所示,其中固体电解质只允许Li+通过。下列说法正确的是

A. 放电时,负极反应式:Li-e-+OH-=LiOH
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
D. Li+穿过固体电解质向正极移动而得到LiOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3是一种重要的化工原料。某课外活动小组尝试制取无水AlCl3并进行相关探究。
资料信息:无水AlCl3在178℃升华,极易潮解,遇到潮湿空气会产生白色烟雾。
(探究一)无水AlCl3的实验室制备
利用下图装置,用干燥、纯净的氯气在加热条件下与纯铝粉反应制取无水AlCl3。供选择的药品:①铝粉②浓硫酸③稀盐酸④饱和食盐水⑤二氧化锰粉末⑥无水氯化钙⑦稀硫酸⑧浓盐酸⑨氢氧化钠溶液。

(1)写出装置A发生的反应方程式__________。
(2)装置E需用到上述供选药品中的________(填数字序号),装置F的作用是__________。
(3)写出无水AlCl3遇到潮湿空气发生反应的化学方程式__________。
(探究二)离子浓度对氯气制备的影响
探究二氧化锰粉末和浓盐酸的反应随着盐酸的浓度降低,反应会停止的原因:
(4)提出假设:假设1.Cl-浓度降低影响氯气的生成;假设2.__________。
(5)设计实验方案:(限选试剂:浓H2SO4、NaCl固体、MnO2固体、稀盐酸)
步骤 | 实验操作 | 预测现象和结论 |
① | 往不再产生氯气的装置中,加入_____继续加热 | 若有黄绿色气体生成,则假设1成立 |
② | __________ | 若有黄绿色气体生成,则假设2成立 |
(探究三)无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如下:
第一次实验 | 第二次实验 | 第三次实验 | |
D中固体用量 | 2.0g | 2.0g | 2.0g |
氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
(6)根据表中数据,计算所得固体中无水AlCl3的质量分数_________。
(7)有人认为D中制得无水AlCl3的质量分数偏低,可能的一种原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或H2、CO)法;③活泼金属置换法;④电解法。这四种方法在工业上均有应用。古代有:(Ⅰ)火烧孔雀石[主要成分是Cu2(OH)2CO3]炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石(主要成分是MgCl2)中炼镁。下列分析不正确的是
A. ①用于(Ⅰ) B. ②用于(Ⅱ) C. ③用于(Ⅲ) D. ④用于(Ⅳ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com