
绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
 试回答:
试回答:
(1)操作Ⅰ为 (填写操作名称)。
(2) 试剂Y与溶液X反应的离子方程式为 。
(3)检验所得绿矾晶体中含有Fe2+的实验操作是 。
(4)操作Ⅲ的顺序依次为: 、冷却结晶、过滤 、 、干燥。
(5)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需 。
②该同学设计的下列滴定方式,最合理的是 (夹持部分略去)(填字母序号)。

③滴定时发生反应的离子方程式为: 。
④判断此滴定实验达到终点的方法是 ;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果 (填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为 。
(18分)
(1)过滤(1分) (2分)
(2)Fe+2Fe3+= 3Fe2+ Fe+2H+=Fe2++H2↑(各2分)
(3)将少许所得晶体放入KSCN溶液不变色,再向溶液中加入氯水变成红色。(2分)(或其它合理答案)
(4)蒸发浓缩、洗涤(各1分)
(5)①1000mL容量瓶 (1分)
②b(1分)
③ 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H20(2分)
④滴加最后一滴KMnO4溶液时,溶液变成紫色且半分钟不再褪色(2分)偏低(1分)
⑤96.7%
【解析】
试题分析:⑴烧渣与H2SO4和O2反应后,形成了固体和溶液,所以操作Ⅰ为过滤,答案:过滤;⑵Y为Fe2(SO4)3 和过量H2SO4,要加Fe将它们转化成FeSO4,反应为:Fe+2Fe3+= 3Fe2+ Fe+2H+=Fe2++H2↑,答案:Fe+2Fe3+= 3Fe2+ Fe+2H+=Fe2++H2↑;
⑶检验所得绿矾晶体中含有Fe2+的实验操作是:先检验溶液中无Fe3+ ,然后,再将Fe2+ 氧化成Fe3+ ,用KSCN溶液检验,答案:将少许所得晶体放入KSCN溶液不变色,再向溶液中加入氯水变成红色。
⑷从FeSO4的水溶液中获得晶体:蒸发浓缩,结晶析出,过滤洗涤,洗涤、干燥,答案:蒸发浓缩、洗涤;
⑸①配制成1000mL溶液,还需要用1000mL容量瓶,答案:1000mL容量瓶;②酸性高锰酸钾具有强氧化性,可以发生橡皮管,应盛放在酸式滴定管内,硫酸亚铁溶液呈酸性,应盛放在酸式滴定管内,故b最合适;故答案为:b;③酸性高锰酸钾具有强氧化性,将Fe2+氧化为Fe3+,被还原为Mn2+,同时生成水,反应离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;④该实验是氧化还原滴定,终点时KMnO4溶液恰好过量一滴,溶液会显紫红色,30秒内不变色,不需要外加指示剂,在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,则所得消耗酸性KMnO4溶液的体积偏小,所测得的Fe2+ 的含量低,故答案为:溶液由无色变为紫红色,30秒内不变色;偏低;
⑤用硫酸酸化的0.01000mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL;依据反应方程式减小计算:
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol·L-1×0.0200L
计算得到;n(Fe2+)=0.001mol;
则1000mL溶液中含Fe2+=0.001mol×1000/25=0.04mol;
FeSO4·7H2O物质的量为0.04mol,质量=0.04mol×278g·mol-1=11.12g;
质量分数= ×100%=96.70%;
×100%=96.70%;
故答案为:96.70%;
考点:硫酸亚铁的制备


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
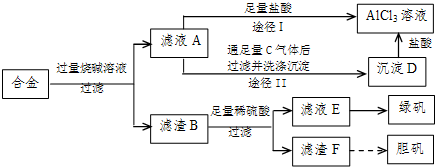
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
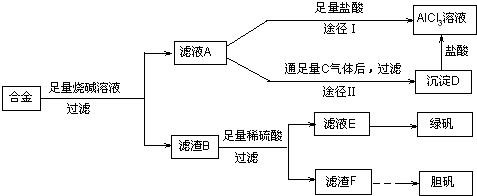


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com