
| A. | 1.6gCH4中含有的电子数 | |
| B. | 100mL1mol/LH2SO4中含有H+的数 | |
| C. | 24gMg与足量稀盐酸反应转移的电子数 | |
| D. | 标准状况下,22.4LCO气体中含有的原子数 |
分析 A.根据n=$\frac{m}{M}$计算甲烷物质的量,1molCH4电子物质的量为10mol,根据N=n×NA计算;
B.根据n=cV计算硫酸的物质的量,再根据硫酸完全电离,溶液中H+的物质的量浓度是硫酸的2倍,c(H+)=2c(H2SO4)、N=n×NA计算;
C.根据n=$\frac{m}{M}$计算24gMg物质的量,1mol金属镁转移2mol电子;
D.根据n=$\frac{v}{{v}_{m}}$计算标准状况下,22.4LCO气体分子数,再根据N=n×NA求算.
解答 解:A.1.6g甲烷物质的量为$\frac{1.6g}{16g/mol}$=0.1mol,电子物质的量为0.1mol×10=1mol,数目约为6.02×1023,故A正确;
B.在 100mL1mol/LH2SO4溶液中n(H2SO4)=0.1L×1mol/L=0.1mol,溶液中含 H+ 的物质的量:n(H+)=2n(H2SO4)=2×0.1mol=0.2mol,N=n×NA=2×6.02×1023,故B错误;
C.24gMg为1mol,1mol金属镁转移2mol电子,所以24 g金属镁与足量的盐酸反应转移的电子为2mol,N=n×NA=2×6.02×1023,故C错误;
D.标准状况下,22.4 L CO气体分子为1mol,因为CO为双原子分子,故原子为2mol,N=n×NA=2×6.02×1023,故D错误;
故选A.
点评 本题考查物质的量的计算,注意对公式的理解与灵活运用,注意物质与微粒的关系,注意气体摩尔体积的运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | [c(H+)•c(OH-)]>1×10-14 | |
| B. | c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-) | |
| C. | c(H+)+2c(H3XO4)+c(H2XO4-)=c(XO43-)+c(OH-) | |
| D. | c(H+)+c(H3XO4)=c(HXO42-)+2c(XO43-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 原电池是一种将化学能转化为电能的装置.在Cu-Zn原电池中,Zn极是电池的负极(填“正极”或“负极”)发生氧化反应(填“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+.
原电池是一种将化学能转化为电能的装置.在Cu-Zn原电池中,Zn极是电池的负极(填“正极”或“负极”)发生氧化反应(填“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.009 mol/(L•s) | B. | 0.006mol/(L•s) | C. | 0.045mol/(L•s) | D. | 0.003mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

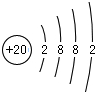 ,写出气体甲的电子式
,写出气体甲的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2A(l)+B(l)=2C(g)△H1=-Q1 | B. | 2A(g)+B(g)=2C(g)△H2=-Q2 | ||
| C. | 2A(g)+B(g)=2C(l)△H3=-Q3 | D. | 2A(l)+B(l)=2C(l)△H4=-Q4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com