
ЁОЬтФПЁПЮэіВЬьЦјИјШЫУЧЕФГіааДјРДСЫМЋДѓЕФВЛБуЃЌвђДЫбаОПNO2ЁЂSO2ЕШДѓЦјЮлШОЮяЕФДІРэОпгаживЊвтвхЁЃ
(1)ФГЮТЖШЯТЃЌвбжЊЃК
Ђй2SO2(g)+O2(g)![]() 2SO3(g) ЁїH1=-196.6kJ/mol
2SO3(g) ЁїH1=-196.6kJ/mol
Ђк2NO(g)+O2(g)![]() 2NO2(g)ЁїH2
2NO2(g)ЁїH2
ЂлNO2(g)+SO2(g)![]() SO3(g)+NO(g) ЁїH3=-41.8kJ/mol
SO3(g)+NO(g) ЁїH3=-41.8kJ/mol
дђЁїH2= _____________ЁЃ
(2)АДЭЖСЯБШ2:1АбSO2КЭO2МгШыЕНвЛУмБеШнЦїжаЗЂЩњЗДгІ2SO2(g)+O2(g)![]() 2SO3(g) ЃЌВтЕУЦНКтЪБSO2ЕФзЊЛЏТЪгыЮТЖШTЁЂбЙЧПpЕФЙиЯЕШчЭММзЫљЪОЃК
2SO3(g) ЃЌВтЕУЦНКтЪБSO2ЕФзЊЛЏТЪгыЮТЖШTЁЂбЙЧПpЕФЙиЯЕШчЭММзЫљЪОЃК

ЂйAЁЂBСНЕуЖдгІЕФЦНКтГЃЪ§ДѓаЁЙиЯЕЮЊKA __________ЃЈЬюЁАЃОЁБЁАЃМЁБЛђЁА=ЁБЃЌЯТЭЌЃЉKBЃЛЮТЖШЮЊT,ЪБDЕуvDе§гыvDФцЕФДѓаЁЙиЯЕЮЊvDе§ _____________vDФцЃЛ
ЂкT1ЮТЖШЯТЦНКтГЃЪ§Kp=______________ kPa-1ЃЈKpЮЊвдЗжбЙБэЪОЕФЦНКтГЃЪ§ЃЌНсЙћБЃСєЗжЪ§аЮЪНЃЉЁЃ
(3)КуЮТКуШнЯТЃЌЖдгкЗДгІ2SO2(g)+O2(g)![]() 2SO3(g)ЃЌВтЕУЦНКтЪБSO3ЕФЬхЛ§ЗжЪ§гыЦ№ЪМ
2SO3(g)ЃЌВтЕУЦНКтЪБSO3ЕФЬхЛ§ЗжЪ§гыЦ№ЪМ![]() ЕФЙиЯЕШчЭМввЫљЪОЃЌдђЕБ
ЕФЙиЯЕШчЭМввЫљЪОЃЌдђЕБ![]() =1.5ДяЕНЦНКтзДЬЌЪБЃЌSO2ЕФЬхЛ§ЗжЪ§ЪЧЭМввжаDЁЂEЁЂFШ§ЕужаЕФ____________ЕуЁЃAЁЂBСНЕуSO2зЊЛЏТЪЕФДѓаЁЙиЯЕЮЊaA ___ЃЈЬюЁАЃОЁБЁАЃМЁБЛђЁА=ЁБЃЉaBЁЃ
=1.5ДяЕНЦНКтзДЬЌЪБЃЌSO2ЕФЬхЛ§ЗжЪ§ЪЧЭМввжаDЁЂEЁЂFШ§ЕужаЕФ____________ЕуЁЃAЁЂBСНЕуSO2зЊЛЏТЪЕФДѓаЁЙиЯЕЮЊaA ___ЃЈЬюЁАЃОЁБЁАЃМЁБЛђЁА=ЁБЃЉaBЁЃ
(4)ЙЄвЕЩЯЭбСђЭбЯѕЛЙПЩВЩгУЕчЛЏбЇЗЈЃЌЦфжаЕФвЛжжЗНЗЈЪЧФкЕчГиФЃЪНЃЈжБНгЗЈЃЉЃЌбЬЦјжаЕФзщЗжжБНгдкЕчГивКжаБЛЮќЪеМАдкЕчМЋЗДгІжаБЛзЊЛЏЃЌВЩгУФкЕчГиФЃЪННЋSO2ЮќЪедкЕчГивКжаЃЌВЂдкЕчМЋЗДгІжабѕЛЏЮЊСђЫсЃЌдкДЫЗДгІЙ§ГЬжаПЩЕУЕНжЪСПЗжЪ§ЮЊ40%ЕФСђЫсЁЃаДГіЭЈШыSO2ЕчМЋЕФЗДгІЪНЃК____________ЃЛШє40%ЕФСђЫсШмвКЮќЪеАБЦјЛёЕУ(NH4)2SO4ЕФЯЁШмвКЃЌВтЕУГЃЮТЯТЃЌИУШмвКЕФpH=5ЃЌдђ![]() ___________ЃЈМЦЫуНсЙћБЃСєвЛЮЛаЁЪ§ЃЌвбжЊИУЮТЖШЯТNH3ЁЄH2OЕФKb=1.7ЁС10-5ЃЉЃЛШєНЋИУШмвКеєЗЂЕєвЛВПЗжЫЎКѓЛжИДЪвЮТЃЌдђ
___________ЃЈМЦЫуНсЙћБЃСєвЛЮЛаЁЪ§ЃЌвбжЊИУЮТЖШЯТNH3ЁЄH2OЕФKb=1.7ЁС10-5ЃЉЃЛШєНЋИУШмвКеєЗЂЕєвЛВПЗжЫЎКѓЛжИДЪвЮТЃЌдђ![]() ЕФжЕНЋ_____ЃЈЬюЁАБфДѓЁБЁАВЛБфЁБЛђЁАБфаЁЁБЃЉЁЃ
ЕФжЕНЋ_____ЃЈЬюЁАБфДѓЁБЁАВЛБфЁБЛђЁАБфаЁЁБЃЉЁЃ
ЁОД№АИЁП-113.0kJЁЄmolЃ1 ЃО ЃМ ![]() D ЃО SO2-2eЃ+2H2O=SO42Ѓ+4H+ 5.9ЁС10-5 БфаЁ
D ЃО SO2-2eЃ+2H2O=SO42Ѓ+4H+ 5.9ЁС10-5 БфаЁ
ЁОНтЮіЁП
ЃЈ1ЃЉгЩИЧЫЙЖЈТЩПЩЕУЂк=Ђй-2ЁСЂлМЦЫуЃЛ
ЃЈ2ЃЉИљОнгАЯьЦНКтГЃЪ§КЭЫйТЪЕФвђЫиНтЮіЃЛСаШ§ЖЮЪНМЦЫуЃЛ
ЃЈ3ЃЉИљОнЭЖСЯЖдЗДгІЕФгАЯьЗжЮіЃЛ
ЃЈ4ЃЉИКМЋЪЇЕчзгЃЌдйНсКЯШмвКЕФЛЗОГЭъГЩЕчМЋЗДгІЃЛНсКЯKwКЭKbНјааМЦЫуЁЃ
(1)гЩИЧЫЙЖЈТЩПЩЕУЂк=Ђй-2ЁСЂлЃЌЫљвдЁїH2=ЁїH1Ѓ2ЁїH3=-196.6kJЁЄmolЃ1-2ЁС(-41.8kJЁЄmolЃ1)=-113.0kJЁЄmolЃ1ЁЃ
(2)Ђй2SO2(g)+O2(g)![]() 2SO3(g)ЗДгІЗХШШЃЌбЙЧПвЛЖЈЪБЃЌЮТЖШдНЕЭЃЌSO2ЕФзЊЛЏТЪдНДѓЃЌЫљвдT1ЃМT2ЃЌИУЗДгІЕФЦНКтГЃЪ§KЫцЮТЖШЩ§ИпЖјНЕЕЭЃЌЫљвдKAЃОKBЃЛЮТЖШЮЊT1ЪБDЕуSO2ЕФзЊЛЏТЪДѓгкЦНКтзЊЛЏТЪЃЌЫљвдЗДгІашвЊФцЯђвЦЖЏДяЕНЦНКтЃЌМДvе§ЃМvФцЁЃ
2SO3(g)ЗДгІЗХШШЃЌбЙЧПвЛЖЈЪБЃЌЮТЖШдНЕЭЃЌSO2ЕФзЊЛЏТЪдНДѓЃЌЫљвдT1ЃМT2ЃЌИУЗДгІЕФЦНКтГЃЪ§KЫцЮТЖШЩ§ИпЖјНЕЕЭЃЌЫљвдKAЃОKBЃЛЮТЖШЮЊT1ЪБDЕуSO2ЕФзЊЛЏТЪДѓгкЦНКтзЊЛЏТЪЃЌЫљвдЗДгІашвЊФцЯђвЦЖЏДяЕНЦНКтЃЌМДvе§ЃМvФцЁЃ
ЂкбЁШЁCЕуМЦЫуT1ЮТЖШЯТЕФKpжЕЃЌЩшSO2ЕФЦ№ЪММгШыСПЮЊ2molЃК

SO2%=![]() ЃЌO2%=
ЃЌO2%=![]() ЃЌSO3%=
ЃЌSO3%=![]() ЁЃгЩгкЗжбЙ=змбЙЁСЮяжЪЕФСПЗжЪ§ЃЌЫљвдCЦНКтЕуИїЮяжЪЕФЗжбЙЗжБ№ЮЊp(SO2)=
ЁЃгЩгкЗжбЙ=змбЙЁСЮяжЪЕФСПЗжЪ§ЃЌЫљвдCЦНКтЕуИїЮяжЪЕФЗжбЙЗжБ№ЮЊp(SO2)=![]() pcЃЌp(O2)=
pcЃЌp(O2)=![]() pcЃЌP(SO3)=
pcЃЌP(SO3)=![]() pcЃЌKp=
pcЃЌKp= kPa-1ЁЃ
kPa-1ЁЃ
ЃЈ3ЃЉЕБЗДгІЮяЕФЭЖСЯБШЕШгкЗНГЬЪНЕФЯЕЪ§БШМД![]() =2ЪБЃЌSO3ЕФЦНКтЬхЛ§ЗжЪ§зюДѓЃЌЫљвдЕБЭЖСЯБШ
=2ЪБЃЌSO3ЕФЦНКтЬхЛ§ЗжЪ§зюДѓЃЌЫљвдЕБЭЖСЯБШ![]() =1.5ДяЕНЦНКтзДЬЌЪБЃЌSO3ЕФЬхЛ§ЗжЪ§ЪЧдкЭЖСЯБШ
=1.5ДяЕНЦНКтзДЬЌЪБЃЌSO3ЕФЬхЛ§ЗжЪ§ЪЧдкЭЖСЯБШ![]() =1ЪБSO3ЕФЦНКтЬхЛ§ЗжЪ§ЕФЛљДЁЩЯМЬајдіДѓЃЌЫљвдгІИУЪЧDЕуЃЌгЩгкДгAЕНBжЛдіМгСЫSO2ЕФСПЃЌЫљвдSO2зЊЛЏТЪЕФДѓаЁЮЊaAЃОaBЁЃ
=1ЪБSO3ЕФЦНКтЬхЛ§ЗжЪ§ЕФЛљДЁЩЯМЬајдіДѓЃЌЫљвдгІИУЪЧDЕуЃЌгЩгкДгAЕНBжЛдіМгСЫSO2ЕФСПЃЌЫљвдSO2зЊЛЏТЪЕФДѓаЁЮЊaAЃОaBЁЃ
(4)вђЮЊSO2дкЕчГижаБЛбѕЛЏГЩСђЫсЃЌЫљвдSO2гІИУДгИКМЋЭЈШыЃЌИКМЋЪЇЕчзгЃЌдйНсКЯШмвКЕФЛЗОГЭъГЩЕчМЋЗДгІЃКSO2-2eЃ+2H2O=SO42-+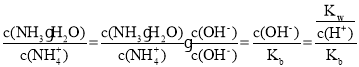 =
=![]() 5.9ЁС10-5ЃЌЩш(NH4)2SO4ШмвКЕФХЈЖШЮЊcЃЌNH4+ЕФЫЎНтГЬЖШЮЊaЃЌдђ
5.9ЁС10-5ЃЌЩш(NH4)2SO4ШмвКЕФХЈЖШЮЊcЃЌNH4+ЕФЫЎНтГЬЖШЮЊaЃЌдђ![]() ЃЌеєЗЂЕєвЛВПЗжЫЎКѓЛжИДЪвЮТЃЌШмвКХЈЖШдіДѓЃЌЫЎНтГЬЖШМѕаЁЃЌ(1-a)діДѓЃЌБШжЕБфаЁЁЃ
ЃЌеєЗЂЕєвЛВПЗжЫЎКѓЛжИДЪвЮТЃЌШмвКХЈЖШдіДѓЃЌЫЎНтГЬЖШМѕаЁЃЌ(1-a)діДѓЃЌБШжЕБфаЁЁЃ


 вЛОэИуЖЈЯЕСаД№АИ
вЛОэИуЖЈЯЕСаД№АИ УћаЃзївЕБОЯЕСаД№АИ
УћаЃзївЕБОЯЕСаД№АИ ЧсЧЩЖсЙкжмВтдТПМжБЭЈУћаЃЯЕСаД№АИ
ЧсЧЩЖсЙкжмВтдТПМжБЭЈУћаЃЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаУшЪіе§ШЗЕФЪЧ
A.![]() ЕФПеМфЙЙаЭЮЊЦНУцШ§НЧаЮ
ЕФПеМфЙЙаЭЮЊЦНУцШ§НЧаЮ
B.![]() КЭ
КЭ![]() ЕФжааФдзгОљЮЊ
ЕФжааФдзгОљЮЊ![]() дгЛЏ
дгЛЏ
C.![]() Зжзгжа
Зжзгжа![]() Мќгы
Мќгы![]() МќЕФЪ§ФПБШЮЊ1ЃК1
МќЕФЪ§ФПБШЮЊ1ЃК1
D.![]() жага6ЖдЯрЭЌЕФГЩМќЕчзгЖд
жага6ЖдЯрЭЌЕФГЩМќЕчзгЖд
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙигкгаЛњЗДгІРраЭЕФвдЯТХаЖЯВЛе§ШЗЕФЪЧ
бЁЯю | гаЛњЗДгІ | ЗДгІРраЭ |
A | БНгыH2ЗДгІЩњГЩЛЗМКЭщ | МгГЩЗДгІ |
B | МзЭщгыТШЦјЛьКЯЙтееБЌеЈ | ШЁДњЗДгІ |
C | ввЯЉгыфхЕФCCl4ШмвКЗДгІ | ШЁДњЗДгІ |
D | ввЯЉЪЙЫсадИпУЬЫсМиШмвКЭЪЩЋ | бѕЛЏЗДгІ |
A.AB.BC.CD.D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌЫЎДцдкШчЯТЕчРыЃКH2O![]() H++OH- H>0ЃЌЯТСаа№Ъіе§ШЗЕФЪЧ
H++OH- H>0ЃЌЯТСаа№Ъіе§ШЗЕФЪЧ
A.ЯђЫЎжаЕЮШыЩйСПЯЁбЮЫсЃЌЦНКтФцЯђвЦЖЏЃЌKwМѕаЁ
B.НЋЫЎМгШШЃЌKwдіДѓЃЌpHМѕаЁ
C.ЯђЫЎжаМгШыЩйСПЙЬЬхNH4ClЃЌЦНКтФцЯђвЦЖЏЃЌc(H+)НЕЕЭ
D.ЯђЫЎжаМгШыЩйСПЙЬЬхСђЫсФЦЃЌc(H+)=10-7mol/LЃЌKwВЛБф
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏКЯЮяZYX4ЪЧдкЛЏЙЄСьгђгазХживЊгІгУМлжЕЕФРызгЛЏКЯЮяЃЌЕчзгЪНШчЭМЫљЪОЁЃXЁЂYЁЂZЪЧдзгађЪ§вРДЮдіДѓЕФЖЬжмЦкдЊЫиЃЌЦфжажЛгавЛжжЮЊН№ЪєдЊЫиЃЌXЪЧжмЦкБэжадзгАыОЖзюаЁЕФдЊЫиЁЃЯТСаа№ЪіжаДэЮѓЕФЪЧ ( )
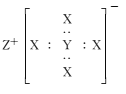
A.ZЪЧЖЬжмЦкдЊЫижаН№ЪєадзюЧПЕФдЊЫи
B.YЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяГЪШѕЫсад
C.XЁЂYПЩвдаЮГЩЗжзгЪНЮЊYX3ЕФЮШЖЈЛЏКЯЮя
D.ЛЏКЯЮяZYX4гаЧПЛЙдад
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкЫФИіВЛЭЌЕФШнЦїжаЃЌдкВЛЭЌЬѕМўЯТРћгУN2+3H2==2NH3ЗДгІРДКЯГЩАБЃЌИљОнЯТСадкЯрЭЌЪБМфФкВтЖЈЕФНсЙћХаЖЯЃЌЩњГЩАБЕФЫйТЪзюДѓЕФЪЧ ЃЈ ЃЉ
A. v(H2)=0.1 molЁЄ(LЁЄmin)1B. v(N2)=0.01 molЁЄ(LЁЄs)1
C. v(N2)=0.2 molЁЄ(LЁЄmin)1D. v(NH3)=0.3 molЁЄ(LЁЄmin)1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.дкКЯГЩАБЙЄвЕжаЃЌвЦзпNH3ПЩдіДѓе§ЗДгІЫйТЪЃЌЬсИпдСЯзЊЛЏТЪ
B.КуЮТЯТНјааЕФЗДгІ2NO2(g)![]() N2O4(g)ДяЦНКтЪБЃЌШнЛ§ВЛБфГфШы2molЕФNO2ЃЌдђдйДЮДяЕНЦНКтЪБNO2ЕФЬхЛ§ЗжЪ§БШдЦНКтДѓ
N2O4(g)ДяЦНКтЪБЃЌШнЛ§ВЛБфГфШы2molЕФNO2ЃЌдђдйДЮДяЕНЦНКтЪБNO2ЕФЬхЛ§ЗжЪ§БШдЦНКтДѓ
C.ГЃЮТЯТЃЌMgO(s)ЃЋC(s)ЃНMg(s)ЃЋCO(g)ВЛФмздЗЂНјааЃЌдђЦфЁїHЃО0
D.ГЃЮТЯТpH=2ЕФбЮЫсжагЩH2OЕчРыГіЕФc(HЃЋ)ЃН1.0ЁС10Ѓ2molЁЄLЃ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2002ФъХЕБДЖћЛЏбЇНБЛёЕУепЕФЙБЯзжЎвЛЪЧЗЂУїСЫЖдгаЛњЮяЗжзгНјааНсЙЙЗжЮіЕФжЪЦзЗЈЁЃЦфЗНЗЈЪЧШУМЋЩйСПЕФЃЈ10Ѓ9gЃЉЛЏКЯЮяЭЈЙ§жЪЦзвЧЕФРызгЛЏЪвЪЙбљЦЗЗжзгДѓСПРызгЛЏЃЌЩйСПЗжзгЫщСбГЩИќаЁЕФРызгЁЃШчC2H6РызгЛЏКѓПЩЕУЕНC2H6ЃЋЁЂC2H5ЃЋЁЂC2H4ЃЋЁЁЃЌШЛКѓВтЖЈЦфжЪКЩБШЁЃФГгаЛњЮябљЦЗЕФжЪКЩБШШчЯТЭМЫљЪОЃЈМйЩшРызгОљДјвЛИіЕЅЮЛе§ЕчКЩЃЌаХКХЧПЖШгыИУРызгЕФЖрЩйгаЙиЃЉЃЌдђИУгаЛњЮяПЩФмЪЧЃЈ ЃЉ
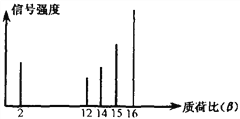

A. МзДМ B. БћЭщ C. МзЭщ D. ввЯЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЯГЩЦјЕФжївЊГЩЗжЪЧвЛбѕЛЏЬМКЭЧтЦјЃЌПЩгУгкКЯГЩЖўМзУбЕШЧхНрШМСЯЃЎДгЬьШЛЦјЛёЕУКЯГЩЦјЙ§ГЬжаПЩФмЗЂЩњЕФЗДгІгаЃК
ЂйCH4(g)+H2O(g)![]() CO(g)+3H2(g) ЁїH1=+206.1kJ/mol
CO(g)+3H2(g) ЁїH1=+206.1kJ/mol
ЂкCH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ЁїH2=+247.3kJ/mol
2CO(g)+2H2(g) ЁїH2=+247.3kJ/mol
ЂлCO(g)+H2O(g)![]() CO2(g)+H2(g) ЁїH3=Ѓ41.2kJ/mol
CO2(g)+H2(g) ЁїH3=Ѓ41.2kJ/mol
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉдквЛУмБеШнЦїжаНјааЗДгІЂйЃЌВтЕУCH4ЕФЮяжЪЕФСПХЈЖШЫцЗДгІЪБМфЕФБфЛЏШчЭМ1ЫљЪОЃЎЗДгІНјааЕФЧА5minФкЃЌv (H2)=_____ЃЛ10minЪБЃЌИФБфЕФЭтНчЬѕМўПЩФмЪЧ________ЁЃ
ЃЈ2ЃЉШчЭМ2ЫљЪОЃЌдкМзЁЂввСНШнЦїжаЗжБ№ГфШыЕШЮяжЪЕФСПЕФCH4КЭCO2ЃЌЪЙМзЁЂввСНШнЦїГѕЪМШнЛ§ЯрЕШЃЎдкЯрЭЌЮТЖШЯТЗЂЩњЗДгІЂкЃЌВЂЮЌГжЗДгІЙ§ГЬжаЮТЖШВЛБфЃЎвбжЊМзШнЦїжаCH4ЕФзЊЛЏТЪЫцЪБМфБфЛЏЕФЭМЯѓШчЭМ3ЫљЪОЃЌЧыдкЭМ3жаЛГіввШнЦїжаCH4ЕФзЊЛЏТЪЫцЪБМфБфЛЏЕФЭМЯѓ_____ЁЃ
ЃЈ3ЃЉ800ЁцЪБЃЌЗДгІЂлЕФЛЏбЇЦНКтГЃЪ§K=1.0ЃЌФГЪБПЬВтЕУИУЮТЖШЯТЕФУмБеШнЦїжаИїЮяжЪЕФЮяжЪЕФСПМћЯТБэЃК
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
ДЫЪБЗДгІЂлжае§ЁЂФцЗДгІЫйТЪЕФЙиЯЕЪНЪЧ____________(ЬюДњКХ)ЁЃ
aЃЎv(е§)ЃОv (Фц) bЃЎv(е§)ЃМv (Фц)
cЃЎv(е§)= v (Фц) dЃЎЮоЗЈХаЖЯЃЎ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com