
【题目】25℃时纯水的电离度为a1,pH=2的醋酸溶液中水的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a4。下列关系式中正确的是( )
A. a2=a3<a4<a1B. a3=a2<a1<a4
C. a2<a3<a1<a4D. a1<a2<a3<a4
【答案】A
【解析】
在25℃时,纯水中c(H+)=c(OH-)=![]() =10-7mol·L-1,纯水的电离度为a1;pH=2的醋酸溶液中c(H+)=10-2mol·L-1,水电离出来的氢离子的浓度与氢氧根的浓度相等,即c(H+)水=c(OH-)水=
=10-7mol·L-1,纯水的电离度为a1;pH=2的醋酸溶液中c(H+)=10-2mol·L-1,水电离出来的氢离子的浓度与氢氧根的浓度相等,即c(H+)水=c(OH-)水=![]() mol·L-1=10-12mol·L-1,水的电离度为a2,醋酸电离出来的氢离子要抑制水的电离,a2<a1;同理可得pH=12的氢氧化钠溶液中c(OH-)=10-2mol·L-1,c(H+)水=c(OH-)水=
mol·L-1=10-12mol·L-1,水的电离度为a2,醋酸电离出来的氢离子要抑制水的电离,a2<a1;同理可得pH=12的氢氧化钠溶液中c(OH-)=10-2mol·L-1,c(H+)水=c(OH-)水=![]() mol·L-1=10-12mol·L-1,水的电离度为a3=a2<a1;pH=2的醋酸溶液和pH=12的氢氧化钠溶液等体积混合,醋酸是弱电解质,所以醋酸过量,溶液仍显酸性,溶液的pH<2,对水的电离抑制作用小于pH=2的醋酸溶液,c(H+)水=c(OH-)水>10-12mol·L-1,溶液中水的电离度为a4,所以有a2=a3<a4<a1;故选A。
mol·L-1=10-12mol·L-1,水的电离度为a3=a2<a1;pH=2的醋酸溶液和pH=12的氢氧化钠溶液等体积混合,醋酸是弱电解质,所以醋酸过量,溶液仍显酸性,溶液的pH<2,对水的电离抑制作用小于pH=2的醋酸溶液,c(H+)水=c(OH-)水>10-12mol·L-1,溶液中水的电离度为a4,所以有a2=a3<a4<a1;故选A。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.158 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸
(2)在溶液配制过程中,下列操作正确且对配制结果没有影响的是__________。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(3)配制上述500mL“鲜花保鲜剂”所需的玻璃仪器有:烧杯、玻璃棒、_____________、__________。(在横线上填写所缺仪器的名称)
(4)鲜花保鲜剂中K+(蔗糖、阿司匹林中不含K+) 的物质的量浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用石墨作电极电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.过量的铁粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2O32-+5H2O=10H++2SO42-+8Cl-
D.SO2通入FeCl3溶液中:SO2+Fe3++2H2O=SO42-+Fe2++4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型绿色消毒剂,其在消毒(发生氧化还原反应)后可形成Fe(OH)3胶体,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。
(1)干法制备高铁酸钾时,先制备得到Na2FeO4,反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中,氧化剂是________,氧化产物是________。
②每生成1 mol Na2FeO4,转移________mol电子。
(2)配平湿法制备高铁酸钾反应的离子方程式:______Fe(OH)3+______ClO-+______OH-=______FeO42-+______Cl-+______H2O
(3)取少量K2FeO4溶液,滴加盐酸,有Cl2产生,该反应表明氧化性:K2FeO4______(填“>”或“<”)Cl2。
(4)Fe(OH)3胶体可使水中悬浮物沉降下来,用作净水剂。实验室用饱和氯化铁溶液制取Fe(OH)3胶体的化学方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是化学反应原理的重要组成部分。请回答下列问题:
(1)已知一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)。
2SO3(g)ΔH<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)。
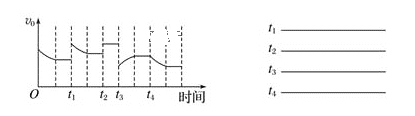
_______、________、_______、______
(2)探究反应条件对0.l0 mol·L-1Na2S2O3溶液与稀H2SO4反应速率的影响。其设计与测定结果如表:
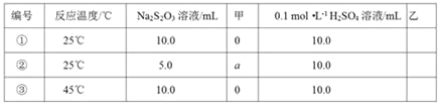
上述实验①③是探究____对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为____,a为____;乙是实验需要测量的物理量,则表格中“乙”为____。
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是___的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入____(填字母)。
A.硫酸钾 B.氯化锰 C.硫酸锰 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W![]() X+H2O+CO2↑ ②Z+CO2―→X+O2
X+H2O+CO2↑ ②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑ ④X+Ca(OH)2―→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是W__________、X__________、Y__________、Z__________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中的氧化剂是____________(写化学式),还原剂是____________(写化学式)。
(3)若反应④在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:________________。
②化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硫酸和木炭粉在加热条件下反应:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,根据如图回答问题:
CO2↑+2SO2↑+2H2O,根据如图回答问题:
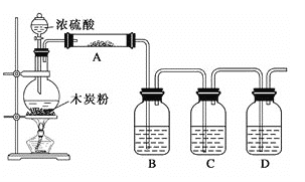
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气?__。
(2)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
①A中加入的试剂是___,作用是___;
②B中加入的试剂是___,作用是___;
③C中加入的试剂是___,作用是___;
④D中加入的试剂是___,作用是___。
(3)实验时,C中应观察到的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是( )
A.分子式为C9H18O2的酯,在酸性条件下加热可水解产生相对分子质量相同的两种有机物,则符合此条件的C9H18O2的结构有18种
B.甲苯和Cl2在光照下的反应与乙醇和乙酸在浓硫酸作用下的反应属于同一类型的反应
C.lmol![]() 与NaOH溶液反应,最多可消耗3molNaOH
与NaOH溶液反应,最多可消耗3molNaOH
D.淀粉、油脂和蛋白质都能在NaOH作用下发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com