
分析 (1)氢氧化钠与盐酸发生中和反应反应生成NaCl与水;
(2)根据n=$\frac{m}{M}$计算NaOH的物质的量;
(3)NaOH与HCl的物质的量相等,结合c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)氢氧化钠与盐酸发生中和反应反应生成NaCl与水,反应方程式为:NaOH+HCl=NaCl+H2O,
故答案为:NaOH+HCl=NaCl+H2O;
(2)NaOH的摩尔质量为40g/mol,20g NaOH的物质的量为$\frac{20g}{40g/mol}$=0.4mol,
答:20g NaOH的物质的量为0.4mol;
(3)由NaOH+HCl=NaCl+H2O,可知n(HCl)=n(NaOH)=0.2mol,盐酸的物质的量浓度为$\frac{0.2mol}{0.1L}$=2mol/L,
答:该盐酸的物质的量浓度为2mol/L.
点评 本题考查物质的量有关计算、化学方程式计算,比较基础,旨在考查学生对基础知识的巩固,掌握以物质的量为中心的有关计算.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素都可以用(C6H10O5)n表示,所以二者属于同分异构体 | |
| B. | 蛋白质溶液中加入重金属盐而凝聚,但蛋白质不会失去生理活性 | |
| C. | 油脂的皂化反应是在碱性条件下发生水解反应 | |
| D. | 所有有机物中都含有官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol•L-1 | B. | 2 mol•L-1 | C. | 2.5 mol•L-1 | D. | 3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除②以外 | B. | 除④以外 | C. | 除⑤以外 | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ⅥA 元素的各种性质可归纳整理如下:
ⅥA 元素的各种性质可归纳整理如下:| 性质 | 8O | 16S | 34Se | 52Te |
| 单质熔点/℃ | -218.4 | 113 | 271 | 450 |
| 单质沸点/℃ | -183 | 444.6 | 685 | 1390 |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | X | Y | Z | Q |
| 时间 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3和H2O化学反应速率关系是2v正(NH3)=3v正(H2O) | |
| B. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 | |
| D. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
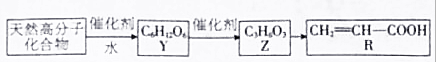


查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com