
【题目】研究苯酚与FeCl3溶液的显色反应,实验如下:
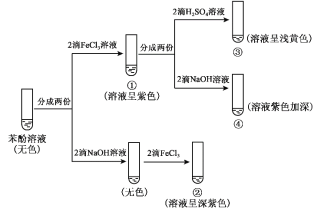
下列说法不正确的是( )
A.苯酚的电离方程式是 ![]()
![]()
![]() +H+
+H+
B.向试管②中滴加硫酸至过量,溶液颜色变为浅黄色
C.对比①③中的现象说明,滴加稀硫酸后,c(Fe3+)变小
D.对比①②、①④中的现象,说明紫色物质的生成与溶液中c(![]() )相关
)相关
科目:高中化学 来源: 题型:
【题目】将a g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A. a g B. ![]() g
g
C. ![]() g D.
g D. ![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol/L二元弱酸H2A溶液中滴加0.1mol/LNaOH溶液,溶液中的H2A、HA-、A2 -的物质的量分数δ(x)随pH的变化如图所示。下列说法错误的是

A.pH =1.9时,c(Na+)<c(HA-)+2c(A2-)
B.当c(Na+)=c(H2A)+c(HA-)+c(A2-)时,溶液pH>7
C.pH=6时,c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.lg[Ka2(H2A)]=-7.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体![]() 。
。
Ⅰ![]() (查阅资料)
(查阅资料)
(1)![]() 是无色透明晶体,易溶于水,其稀溶液与
是无色透明晶体,易溶于水,其稀溶液与![]() 溶液混合无沉淀生成。
溶液混合无沉淀生成。
(2)向![]() 和
和![]() 混合溶液中通入
混合溶液中通入![]() 可制得
可制得![]() ,所得产品常含有少量
,所得产品常含有少量![]() 和
和![]() 。
。
(3)![]() 易被氧化;
易被氧化;![]() 难溶于水,可溶于稀盐酸。
难溶于水,可溶于稀盐酸。
Ⅱ![]() (制备产品)
(制备产品)
实验装置如图所示![]() 省略夹持装置
省略夹持装置![]() :
:

实验步骤:
(1)检查装置A、B气密性的方法是______,如图示加入试剂。仪器b的名称是______;E中的试剂是______![]() 选填下列字母编号
选填下列字母编号![]()
A.稀![]()
B.饱和![]() 溶液
溶液
C.饱和![]() 溶液
溶液
D.NaOH溶液
(2)先向C中烧瓶加入![]() 和
和![]() 的混合溶液,再向A中烧瓶滴加浓
的混合溶液,再向A中烧瓶滴加浓![]() 。
。
(3)待![]() 和
和![]() 完全消耗后,结束反应。过滤C中的混合物,滤液经蒸发、结晶、过滤、______、干燥、得到产品
完全消耗后,结束反应。过滤C中的混合物,滤液经蒸发、结晶、过滤、______、干燥、得到产品![]() 填写操作名称
填写操作名称![]() 。
。
Ⅲ![]() (探究与反思)
(探究与反思)
(1)为验证产品中含有![]() 和
和![]() ,该小组设计了以下实验方案,请将方案补充完整
,该小组设计了以下实验方案,请将方案补充完整![]() 所需试剂从稀
所需试剂从稀![]() 、稀
、稀![]() 、稀盐酸、蒸馏水中选择
、稀盐酸、蒸馏水中选择![]() .取适量产品配成稀溶液,滴加足量
.取适量产品配成稀溶液,滴加足量![]() 溶液,有白色沉淀生成,______,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有
溶液,有白色沉淀生成,______,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有![]() 和
和![]() 。
。
(2)为减少装置C中生成![]() 的量,在不改变原有装置的基础上对实验步骤
的量,在不改变原有装置的基础上对实验步骤![]() 进行了改进,改进后的操作是______。
进行了改进,改进后的操作是______。
(3)![]() 的溶解度随温度升高显著增大,所得产品通过______方法提纯。
的溶解度随温度升高显著增大,所得产品通过______方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
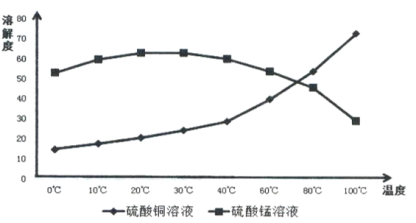
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分MnO2,它们都含有少量Fe2O3、SiO2等杂质。工业上综合利用这两种矿物制备硫酸铜、硫酸锰和硫单质的主要工艺流程如下:

(1)浸取2过程中温度控制在500C~600C之间的原因是__________________。
(2)硫酸浸取时,Fe3+对MnO2氧化Cu2S起着重要催化作用,该过程可能经过两岁反应完成,将其补充完整:
①_____________________________(用离子方程式表示)
②MnO2+2Fe2++4H+= Mn2++2Fe3++2H2O
(3)固体甲是一种碱式盐,为测定甲的化学式,进行以下实验:
步骤1:取19.2 g固体甲,加足量的稀盐酸溶解,将所得溶液分为A、B两等份;
步骤2:向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下)过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得4.80g红棕色固体残渣:
步骤3:向B中加入足量的BaCl2溶液,过滤、洗涤、干燥,可得9.32g固体残渣。
则固体甲的化学式为_________________
(4)相关物质的溶解度如下图,从除铁后的溶液中通过一系列的操作分别获得硫酸铜、硫酸锰晶体,请给出合理的操作顺序(从下列操作中选取,按先后次序列出字母,操作可重复使用):溶液→( ) →( )→( ) →(A) →( ) →( ) →( ),_____________
A.蒸发溶剂 B.趁热过滤 C.冷却结晶 D.过滤
E.将溶液蒸发至溶液表面出现晶膜 F.将溶液蒸发至容器底部出现大量晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C6H14的各种同分异构体中所含甲基数和它的一氯取代物的数目分别是( )
A.2个甲基,能生成4种一氯代物 B.4个甲基,能生成1种一氯代物
C.3个甲基,能生成5种一氯代物 D.4个甲基,能生成4种一氯代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用甲烷与水蒸气的催化重整反应制取水煤气。T℃时,每生成5.6gCO该反应吸热40.6kJ。
(1)该反应的热化学方程式为_____;
(2)该反应的逆反应速率方程为v逆=k逆·cm (CO)·cn (H2), k逆、m、n需要通过实验测定。T℃时,测得有关数据为:
序号 | c(CO)/mol·L-1 | c(H2)/mol·L-1 | v逆/mol·L﹣1·min-1 |
Ⅰ | 0.05 | 0.02 | 4.80×10-3 |
Ⅱ | 0.03 | 0.05 | 4.50×10-2 |
Ⅲ | 0.02 | 0.02 | 1.92×10-3 |
Ⅳ | 0.03 | 0.01 | 3.60×10-4 |
通过计算,k逆的数值为___,当c(CO)=0.01mol/L、c(H2)=0.03mol/L时,v逆=___________;
(3)在体积为3 L的密闭容器中,加入甲烷和水蒸气各3 mol,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度、压强的关系如图所示,则压强P1___P2(“>”、“=”或“<”);温度为T4℃、压强为P1 MPa时,N点表示的体系状态v正_____v逆(填“>”、“=”或“<”);若P1 =5.0×103 MPa,M点表示的体系状态CH4的平衡转化率为_______、压强平衡常数KP=___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列粒子(分子或离子)均含有18个电子:
粒子 | A+ | B2- | C | D | E | F |
组成特点 | 单核离子 | 化合物,双核分子 | 单质,双核分子 | 化合物,三核分子 | 化合物,四核分子 | |
请回答下列问题:
(1)A的元素符号是____________,B2-的结构示意图是________。
(2)C与D混合,发生反应的化学方程式为_____________________________________。
(3)E的电子式是________;F的水溶液常用于消毒剂,F的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
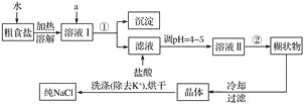
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式)。
②分离操作①中所用到的玻璃仪器有____________。
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________。
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)在实验中多次用到玻璃棒,其作用有三个,分别是______________、______________、______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com