
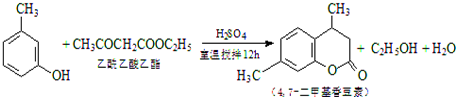
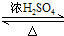 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离. 分析 本题考查的是利用间-甲苯酚合成4,7-二甲基香豆素的探究实验,涉及反应过程中的操作注意点,如为了使漏斗中液体顺利流下装置b中必须将活塞上下部分连通,为了降低浓硫酸的强氧化性,需将温度冷却至0℃以下,为了使反应充分需要不断搅拌,另外还考查了用乙醇与乙酸混合加热制乙酸乙酯的原理;
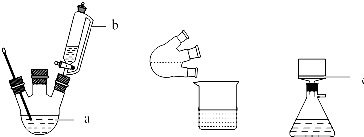
(1)根据实验的需要结合大气压强原理来回答,装置b中将活塞上下部分连通,能平衡上下气压,使漏斗中液体顺利流下;
(2)浓硫酸具有强氧化性和脱水性,温度高能使有机物氧化和脱水碳化;
(3)反应需要搅拌12h,使反应物充分接触反应,提高反应产率;
(4)已知间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL (0.21mol),若完全反应间甲苯酚过量,按照乙酰乙酸乙酯计算求出理论产量,再求出产率;
(5)酯化反应的本质为酸脱羟基,醇脱氢,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水;实验室用乙醇和乙酸在浓硫酸作用下加热制备乙酸乙酯;碳酸钠溶液显示碱性;乙酸乙酯不溶于碳酸钠溶液,混合液分层,为了除去乙酸乙酯中的乙醇和乙酸,用碳酸钠溶液吸收,乙酸乙酯与水不互溶,据此分离混合物.
解答 解:(1)装置中装置b中将活塞上下部分连通具有平衡气压的作用,使漏斗中间甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物顺利流下,故答案为:平衡上下气压,使漏斗中液体顺利流下;
(2)浓硫酸具有强氧化性和脱水性,反应温度高浓硫酸能使有机物氧化和脱水碳化,发生副反应,所以浓H2SO4需要冷却至0℃以下,故答案为:防止浓H2SO4将有机物氧化或炭化;
(3)不断的搅拌反应混合物,可以使反应物充分接触反应,从而提高反应产率,故答案为:使反应物充分接触反应,提高反应产率;
(4))已知间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL(0.21mol),若完全反应间甲苯酚过量,按照乙酰乙酸乙酯计算理论产量为0.21mol×176g/mol=36.96g,则产率$\frac{33.0g}{36.96}$×100%≈89.0%,故答案为:89.0%;
(5)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O,制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,乙酸乙酯不溶于水溶液,所以分离的方法为分液,故答案为:CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O,制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,乙酸乙酯不溶于水溶液,所以分离的方法为分液,故答案为:CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O;饱和的碳酸钠溶液;分液.
CH3COOCH2CH3+H2O;饱和的碳酸钠溶液;分液.
点评 本题考查了有机物的制备实验,侧重于实验仪器、实验操作、产率的计算的考查,题目难度中等,考查了学生的实验探究能力.


科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
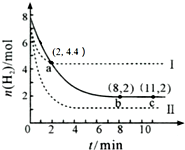
| A. | 该温度下,a点时,3 v正(CO2)=v正(H2) | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 曲线Ⅰ对应的条件改变可能是降低温度 | |
| D. | 从反应开始至a点,v (CO2)=0.6 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反应在前5s的平均速率v(A)=0.17mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(A)=0.41mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入2.0mol C,达到平衡时,C的转化率大于80% | |
| D. | 相同温度下,起始时向容器中充入0.20mol A、0.20mol B和1.0mol C,反应达到平衡前v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com