
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2011-2012学年甘肃省天水市高三第四阶段考试化学试卷 题型:填空题
(10分)⑴肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
⑵肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是 。
负极的电极反应式是 。
⑶右图是一个电化学过程示意图。
① 锌片上发生的电极反应是 。
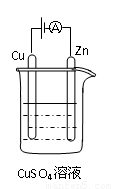
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变
化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L
(假设空气中氧气体积含量为20%)
⑷传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反
应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2011年浙江省高考化学模拟试卷(十二)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com