
| A.将一块铝片投入足量NaOH溶液中,充分反应后铝片消失,将溶液蒸干便可得到纯净NaAlO2 |
| B.将二块相同铝片投入到等物质的量浓度的CuSO4和CuCl2溶液中,反应速率几乎相同 |
| C.将铝粉投入浓NaOH溶液中,1mol铝可还原3mol水 |
| D.将一小块钠投入盛有乙醇的烧杯中,由于钠的密度大于乙醇,所以钠一直在液面下反应 |
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.2:3 | C.1:2 | D.1:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该物质属于两性氢氧化物 | B.该物质是Al(OH)3和Na2CO3的混合物 |
| C.1 mol NaAl(OH)2CO3最多可消耗3 mol H+ | D.该药剂不适合于胃溃疡患者服用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 测得生成气体的体积Vml(已折算成标准状况);
测得生成气体的体积Vml(已折算成标准状况); 测得剩余固体的质量a克;
测得剩余固体的质量a克;  溶液
溶液 测得沉淀的质量b克。
测得沉淀的质量b克。查看答案和解析>>
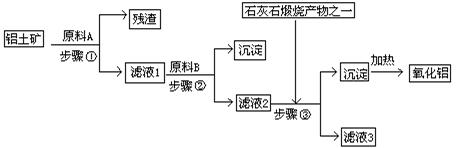
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
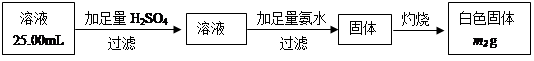
科目:高中化学 来源:不详 题型:填空题
| 实验步骤 | 预期实验现象和结论 |
| 步骤1:将反应所得浊液过滤、洗涤,取少量固体于试管中,加入足量的6mol·L-1 H2SO4溶液,充分振荡,静置。 | ___________________________________, 证明黑色固体含有Si |
| 步骤2: | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1︰2 | B.1︰3 | C.3︰2 | D.1︰1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com