
| ���� | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| Ũ��/mol•L-1 | 4��10-6 | 6��10-6 | 2��10-5 | a | 4��10-5 | 3��10-5 | 2��10-5 |
���� ��1���ٵ��������γ����������������ꣻ
�ڸ��»�����N2��O2��Ӧ����һ��������
��2���ٸƻ�����CaO+SO2+O2=CaSO4��
�ڶ������������������̼������Һ�������գ��������������ƻ��������ƺͰ�ˮ������Һ�������ն�������
��3��������Һ�е���غ���㣮
��� �⣺��1����NOx���γ����꣬��NO2�γɵ�����Ϊ���������꣬������Һ�к��е���Ҫ������H+��NO3-��
�ʴ�Ϊ��H+��NO3-��
����������������ʱ�ĸ��»�����N2��O2��Ӧ����Ӧ�Ļ�ѧ����ʽ��N2+O2�T2NO��
�ʴ�Ϊ��N2+O2�T2NO��
��2������ȼú�м�����ʯ�ҿ�����������ã�SO2�����պ�ת����һ����Ԫ�ص����̬�Ļ�����������ƺͶ�������Ӧ����������ƣ�������Ʊ��������ΰ����ƣ�CaO+SO2+O2=CaSO4�����̬�Ļ�����ΪCaSO4��
�ʴ�Ϊ��CaSO4��
�ڶ������������������
a��Na2CO3��Һ�������ն������������������ƺͶ�����̼����a��ȷ��
b����������ն�������b����
c��NaHSO3�������ն�������c����
d��NH3•H2O�����ն�����������������炙���������泥���d��ȷ��
�ʴ�Ϊ��ad��
��3����Һ�д��ڵ���غ�c��K+��+c��Na+��+c��NH4+��+c��H+��=2c��SO42-��+c��NO3-��+c��Cl-�����ͼ�����ݼ���õ�������Ũ��c��H+��=1��10-4 mol/L��
�ʴ�Ϊ��1��10-4��
���� ���⿼������������ӽṹ�������������ʵķ���Ӧ�ã��ƻ�����ԭ����������������ջ���ע�����֪ʶ�ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
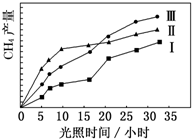 ���ù��ܺ�������ɽ� CO2 �� H2O��g��ת��Ϊ CH4 �� O2�����������ʱ���ڲ�ͬ�������������£�CH4���������ʱ��ı仯��ͼ��ʾ��
���ù��ܺ�������ɽ� CO2 �� H2O��g��ת��Ϊ CH4 �� O2�����������ʱ���ڲ�ͬ�������������£�CH4���������ʱ��ı仯��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.0mol | B�� | 1.6mol | C�� | 2.2mol | D�� | 2.4mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢܢ� | C�� | �٢ڢ� | D�� | �ۢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com