

���� ��1��������ˮ��Ӧ��������ʹ����ᣬ��֤������ˮ��Ӧ�IJ����ͨ����֤�����������ӻ�����ʹ������Ư���Խ��У��Ʊ������к����Ȼ����ˮ������Ӧ�ȳ��Ȼ��⣬����֤������ˮ��Ӧ�IJ�������ﲢ�Դ������������Ϊԭ����ȡFeCl3���Ȼ��⼫�����ڱ���ʳ��ˮ��������������ˮ��
��2��������ˮ��Ӧ��������ʹ����ᣬ������������������ֽⷴӦ���ɰ�ɫ�Ȼ���������������ˮ��Ӧ���ɵĴ�������������Ժ����ԣ���ʹ��ɫʯ���ȱ�����ɫ��
��3�������ж����ӻ����Ƕȿ��ǣ�Ҫ���ж�β����������FeCl3�׳��ⲻ������Һ����β����
��4����KClO3+6HCl��Ũ���TKCl+3Cl2��+3H2O��֪���������ClԪ�ػ��ϼ���+5�۱�Ϊ0�ۡ�HCl��ClԪ�ػ��ϼ���-1�۱�Ϊ0�ۣ�������������������������Ȼ����ǻ�ԭ������ԭ��������������6molHCl�У�5molHCl��ClԪ�ػ��ϼ���-1�۱�Ϊ0�۽��
��� �⣺��1����ʵ��Ŀ���У�����֤������ˮ��Ӧ�IJ�����Դ������������Ϊԭ����ȡFeCl3��ʵ������Ũ����Ͷ��������ڼ��������·�Ӧ�����Ȼ��̡�������ˮ��MnO2+4HCl��Ũ��$\frac{\underline{\;��\;}}{\;}$MnCl2+Cl2��+2H2O��Ũ�����лӷ��ԣ������Ʊ������к����Ȼ����ˮ������Ϊ�ﵽʵ��Ŀ�ģ���Ӧװ���пհײ���Ӧ�ȳ��Ȼ��⣬������ˮ��Ӧ��������ʹ����ᣬʳ��ˮ�к��������ӣ��������������ܽ⣬����Ҫ���ȥ�����е��Ȼ���Ӧ����ʳ��ˮ��װ��C���������ʵ�飬������֤�����������ᣨװ��B��D���������Ũ������װ��E����Ϊʵ���������
�ʴ�Ϊ��CBDE��CDBE��
��2��������ˮ��Ӧ��Cl2+H2O?HCl+HClO�����ᡢ�����ᶼ�������ԣ����Ậ�������ӣ����������Ư���ԣ�����Cl-ʱ������������Cl-�����Ȼ����������������������������Ļ���CO32-������ϡHNO3�ų�CO32-��ͨ��װ��B�е������ữ����������Һ��HCl+AgNO3=AgCl��+HNO3��������ɫ������ͨ��װ��D�е���ɫʯ����Һ���ȱ�����ɫ��������ʹ��ɫ��ʯ����Һ��죬��������������ԣ�ʹ��ɫʯ����Һ��ɫ��
�ʴ�Ϊ����ɫ������������ˮ��Ӧ���������ӻ�����ȱ�����ɫ��������ˮ��Ӧ�д��������ɣ�
��3�������ж�����װ��δ���β������װ�ã�FeCl3����ˮ���⣬����Ҫ����ȡ�Ȼ���װ��֮����һ��������������β��װ�ã����ü��Թ����ʯ�ң���������Ϊ�����ܷ�ֹˮ�ֽ�����ȡ�Ȼ�����װ�ã�
�ʴ�Ϊ��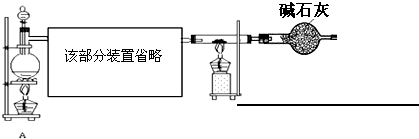
��4���ɷ�ӦKClO3+6HCl=KCl+3Cl2��+3H2O��֪��6molHCl�У�5molHCl��ClԪ�ػ��ϼ���-1�۱�Ϊ0�ۣ�����ԭ����������1molHCl��ClԪ�ػ��ϼ۲���Ϊ�ᣬת�Ƶ���5mol��
����Ӧ����6mol��ԭ������������ת�Ƶ�����Ϊ6mol��
�ʴ�Ϊ��6��
���� ��������ȡ�Ȼ�����ĩΪ���壬�����ʵ�鷽��������ۣ��ؼ�����ʵ��ԭ����Ŀ�ļ���װ�õ����ã���Ŀ�ۺ��Խ�ǿ����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4CO3 $\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O��+CO2�� | B�� | 2Na2O2+2 H2O�T4NaOH+O2�� | ||
| C�� | H2O+Cl2?HCl+HClO | D�� | NH3+SO2+H2O�TNH4HSO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ������������ӷ���ʽ | ���� |
| A | ����CO2ͨ�뱽������Һ�У�2C6H5O-+CO2+H2O��2C6H5OH+CO32- | ��ȷ |
| B | �������е���AgNO3��Һ�������е���Ԫ�أ�Br-+Ag+=AgBr�� | ���������鲻�ܵ����Br- |
| C | Ca��HCO3��2��Һ������ʵ���NaOH��Һ��Ӧ��Ca2++HCO3-+OH-=CaCO3��+H2O | ����Ca2+��HCO3-�����ʵ���֮��Ϊ1��2 |
| D | ����������Һ������ʵ�����ϡ�����ϣ�Ba2++OH-+H++SO42-=BaSO4��+H2O | ��ȷ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
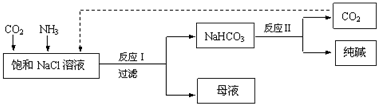
| A�� | ��Ӧ��ԭ��ΪCO2+NH3+NaCl+H2O��NaHCO3��+NH4Cl | |
| B�� | ��NaCl��Һ����ͨ��������CO2����ͨ��������NH3 | |
| C�� | ��Ӧ�����ɵij������������ˡ�ϴ�ӡ����տɵõ����� | |
| D�� | ��ĸҺ��ͨ�백��������ϸС��ʳ�ο��������£���ʹ�Ȼ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com