
����Ŀ��������ͭ��Cu2O����Ϊһ����Ҫ��������ԭ�ϣ���Ϳ�ϡ���ɫ�����ʹ������������Ź㷺����;���ش��������⣺
��1������Cu2O��Ϳ�ϻ�����ɫ��
��2���Ʊ�������ͭ�ķ���֮һ����ͭ���������NaCl��NaOH�����Һ����ԭ����ͼ��ʾ�� 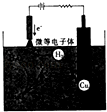
�������ĵ缫��ӦʽΪ ��
����Һ��CuCln1��nת��ΪCu2O�����ӷ���ʽΪ
��3����ҵ�����г����ø�����������ͭ��ĩ�Ʊ�Cu2O�������ò�Ʒ�лẬ��һ����CuO���ⶨ��Ʒ��Cu2O�ĺ������õζ�������ԭ��Ϊ�� ��Ʒ�ܽ⣺Cu2O+Fe2��SO4��3+H2SO4�T2FeSO4+2CuSO4+H2O��
�ζ���δ��ƽ������FeSO4+��KMnO4+��H2SO4�T��Fe2��SO4��3+��MnSO4+��K2SO4+��H2O
����ƽ�ζ���Ӧ�Ļ�ѧ����ʽ��
�ڵζ�ʱ��KMnO4��Һʢ���������ʽ����ʽ�����ζ����У�
������Ʒ����Ϊ1.0g���ζ�ʱ����0.10molL��1��KMnO4����Һ20.00mL�����Ʒ��Cu2O����������Ϊ ��
���𰸡�
��1��ש��
��2��2H++2e��=H2����CuCln1��n+2OH��=Cu2O��+H2O+2nCl��
��3����ʽ��72%
���������⣺��1��������ͭ����ɫ��ש��ɫ����������Cu2O��Ϳб������ש��ɫ�����Դ��ǣ�ש�죻��2�����ڵ��ص�����������Һ�е������ӷ����õ��ӵĻ�ԭ��Ӧ�����ݷŵ�˳�����ķ�ӦΪ��2H++2e��=H2�������Դ��ǣ�2H++2e��=H2�������ڼ��Ի����£�CuCln1��n������������֮�䷢����Ӧ�õ�ת��ɫ���������ӷ���ʽCuCln1��n+2OH��=Cu2O��+ H2O+2nCl�� ��
���Դ��ǣ�CuCln1��n+2OH��=Cu2O��+H2O+2nCl������3���ٷ�ӦFeSO4+KMnO4+H2SO4��Fe2��SO4��3+MnSO4+K2SO4+H20�л��ϼ����ߵ�Ԫ����Fe��������2�ۣ����ϼ۽��͵�Ԫ����Mn������5�ۣ����ݵ����غ㣬����Ԫ�ص�����ǰ��ϵ����2����ԭ������10����������ǰ����10��������ǰ����5������Ԫ���غ㣬��ƽ�������ʣ����Ϊ��10FeSO4+2KMnO4+8H2SO4�T5Fe2��SO4��3+2MnSO4+K2SO4+8H20�����Դ��ǣ�10��2��8��5��2��1��8���ڸ�����ؾ���ǿ�����ԣ�Ӧ��ѡ����ʽ�ζ��ܣ����Դ��ǣ���ʽ���۸��ݷ����ķ�ӦCu2O+Fe2��SO4��3+H2SO4�T2FeSO4+2CuSO4+H2O��10FeSO4+2KMnO4+8H2SO4�T5Fe2��SO4��3+2MnSO4+K2SO4+8H20���ҵ�Cu2O��KMnO4֮��Ĺ�ϵΪ��Cu2O�� ![]() KMnO4 �� ��Ʒ����Ϊ1.0g���ζ�ʱ����0.10molL��1��KMnO4����Һ20.00mL���t��Ʒ��Cu2O�����ʵ�����
KMnO4 �� ��Ʒ����Ϊ1.0g���ζ�ʱ����0.10molL��1��KMnO4����Һ20.00mL���t��Ʒ��Cu2O�����ʵ����� ![]() mol=0.005mol������������
mol=0.005mol������������ ![]() ��100%=72%�����Դ��ǣ�72%��
��100%=72%�����Դ��ǣ�72%��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������һ�ݺ�������MgCl2��KCl��AlCl3��ҺM��ijС������ͼ��ʾ���̶�����г��Ӳ������ܵļ���AlCl3����ʧ����ش��������⣺

��1������A�Ļ�ѧʽΪ__________�����̢���Al3+������Ӧ�����ӷ���ʽΪ__________________��
��2������������Һ_____����ܡ����ܡ����ð�ˮ���棬ԭ����_____________________��
��3����ҺB�д������ڵ���������______________�����̢������ɳ���C�����ӷ���ʽΪ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʵ���Ũ�ȱ�����ȷ������ ��
A. 98%��H2SO4���ʵ���Ũ��Ϊ18.4mol/L ����49%��H2SO4���ʵ���Ũ��Ϊ9.2mol/L
B. ��2Lˮ����44.8L����(���)ʱ���ð�ˮ��Ũ�Ȳ���1molL-1��ֻ�е�44.8L(���)��������ˮ�Ƶ�2L��ˮʱ����Ũ�Ȳ���1molL-1
C. ֻ��K2SO4��NaCl�Ļ��ˮ��Һ�У����Na+��SO42-�����ʵ�����ȣ���K+��Cl-�����ʵ���Ũ��һ����ͬ
D. 50mL 1mol/L��AlCl3��Һ�е�Cl��Ũ����50ml 3mol/L��BaCl2��ҺCl��Ũ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��Cl2�������������������ˮ�������߱��ʵȷ���Ӧ�ù㷺��ij��ȤС��ͨ����ͼ1װ�ã��г�װ���ԣ������Ʊ������ա��ͷź�Ӧ�ý������о��� 
��1������C�������� �� ��װF�е���ʱ��Ӧѡ��ͼ2�е� ��
��2����B�Ļ�����A�з�����Ӧ��2NaClO3+4HCl=2ClO2��+Cl2��+2NaCl+2H2O���÷�Ӧ���������뻹ԭ�����ʵ���֮��Ϊ �� ΪʹClO2��D�б��ȶ���������գ��μ�ϡ������ٶ�������족����������
��3���ر�B�Ļ�����ClO2��D�б��ȶ�����ȫ��������NaClO2 �� ��ʱF����Һ����ɫ���䣬��װ��C�������� ��
��4����֪������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2 �� �÷�Ӧ�����ӷ���ʽΪ �� ��ClO2�ͷ�ʵ���У���E�Ļ�����D�з�����Ӧ����װ��F��������
��5��������ClO2������ȶ�����͢�����ͷ�ClO2��Ũ����ʱ��ı仯����9ͼ3��ʾ������������ˮ�����ʣ�����ΪЧ���Ϻõ��ȶ����� �� ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʳ�ַ�Ӧ����ˣ�����Һ���ȡ����ɡ��������������䣬���ղ��ܵõ����������
A. ��Ư����Һ��ͨ�������CO2
B. ���������Ĥ����Ƭ�м�������
C. ����1molCa(HCO3)2����Һ�м���1molNa2O2
D. ����1molKAl(SO4)2����Һ�м���2molBa(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���谢���ӵ�����ΪNA �� ������˵����ȷ���ǣ� ��
A.15g������CH3�������еĵ�������9NA
B.7.8g ![]() �к��е�̼̼˫����Ϊ0.3NA
�к��е�̼̼˫����Ϊ0.3NA
C.1mol C2H5OH��1mol CH3CO18OH��Ӧ����ˮ��������Ϊ8NA
D.��״���£�11.2L��������������Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�������ʵ���ҳ����Լ���Ҳ����Ҫ�Ĺ�ҵ��Ʒ��
��1��ʵ������ͼIװ����ȡ���� ����װ��I��ҩƷ��ȡ�����Ļ�ѧ����ʽΪ
��I�з�Ӧ��ʼ��һ��ʱ�䷴Ӧ����Խ��Խ�죬�����ԭ����
��2��ʵ��ҿ���������װ�ý��װ�â�ģ�ҵ����ȡ���������鰱�� 
��װ�õ�����˳��Ϊ ![]() ������ӿ���ĸ��
������ӿ���ĸ��
��װ�â�����ϡ��������������������
����˵���а������ɵ�������
��3�����ʵ��֤��NH3H2O��������ʣ�����Ҫ˵������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������һ������ͬϵ����ǣ� ��
A. ��������춡��B. �����ͻ�����C. C2H4��C4H8D. CH3Cl��CH3CH2Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨij�л�������A�Ľṹ����������ʵ�飮 
��1������ʽ��ȷ��
���л���A�����������г��ȼ�գ�ʵ���ã�����5.4gH2O��8.8gCO2 �� ��������6.72L����״���£���������ʵ�ʵ��ʽ�ǣ�
��2�������Dzⶨ�л���A����Է�������Ϊ46��������ʵķ���ʽ��
��3���ṹʽ��ȷ��
Ԥ��A�Ŀ��ܽṹ��д���ṹ��ʽ ��
��4������ʵ��
�˴Ź��������ܶ��л�������в�ͬλ�õ���ԭ�Ӹ�����ͬ�ķ�ֵ���źţ������ݷ�ֵ���źţ�����ȷ����������ԭ�ӵ��������Ŀ�����磺���ȼ��ѣ�Cl��CH2��O��CH3����������ԭ�ӣ���ͼ�ף������ⶨ���л���A�ĺ˴Ź���������ͼ����ʾ����A�Ľṹ��ʽΪ ��
��5��A��һ����������ˮ������B��B�ɺϳ�����ʳƷ��װ������C����ֱ�д��ת����Ӧ��ѧ����ʽ��
A��B����
B��C�� ��
��6�����������е��˶�Ա����Ť��ʱ����ҽ�漴�������飨�е�Ϊ12.27�棩�����˲�λ���оֲ��䶳����������Bѡ����ʵķ����Ʊ������飬Ҫ��ԭ��������Ϊ100%����д���Ʊ���Ӧ����ʽ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com