
| A. | 用水鉴别炭粉和二氧化锰 | |
| B. | 用闻气味的方法鉴别白酒和白醋 | |
| C. | 用澄清石灰水鉴别氮气和二氧化碳 | |
| D. | 用相互刻画的方法鉴别黄铜片和铜片 |
分析 A.炭粉和二氧化锰均为不溶于水的黑色固体;
B.白酒和白醋的气味不同;
C.二氧化碳使石灰水变浑浊,氮气不能;
D.黄铜片为Cu的合金,硬度比Cu大.
解答 解:A.炭粉和二氧化锰均为不溶于水的黑色固体,则加水不能鉴别,故A错误;
B.白酒和白醋的气味不同,则用闻气味的方法鉴别白酒和白醋,故B正确;
C.二氧化碳使石灰水变浑浊,氮气不能,则用澄清石灰水可鉴别氮气和二氧化碳,故C正确;
D.黄铜片为Cu的合金,硬度比Cu大,则用相互刻画的方法可鉴别黄铜片和铜片,故D正确;
故选A.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
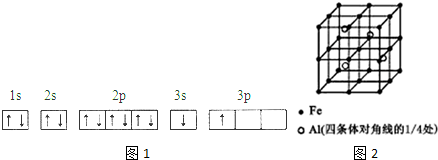
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
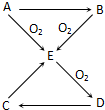 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
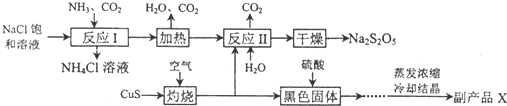
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com