
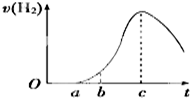
 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.分析 由图可知,开始不生成氢气,为氧化铝与硫酸的反应,然后Al与硫酸反应生成氢气,开始温度较低,由于反应放热,则温度升高反应速率加快,后来,氢离子浓度减小,则反应速率减小,以此来解答.
解答 解:(1)曲线由0→a段不产生氢气是因氧化铝与硫酸反应生成硫酸铝和水,离子反应为Al2O3+6H+=2Al3++3H2O,
故答案为:氧化铝与硫酸反应生成硫酸铝和水;Al2O3+6H+=2Al3++3H2O;
(2)线由b→c段,产生氢气的速率增加较快的主要原因为该反应为放热反应,温度升高,反应速率加快,故答案为:反应放热使溶液温度升高;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因为氢离子浓度减小,反应速率减小,故答案为:溶液中的氢离子浓度降低;
(4)催化剂加快反应速率,不影响氢气的产量,故答案为:不会;
(5)将铝片和铜片用导线相连,一组插入浓硝酸中,铝钝化,所以Cu失电子作负极,一组插入烧碱溶液中,Cu与氢氧化钠不反应,Al失电子作负极,
碱性条件下,Al失电子生成偏铝酸根离子,其电极反应为:Al+4OH--3e-=AlO2-+2H2O;
故答案为:B.
点评 本题考查Al的化学性质及影响反应速率的因素,为高频考点,把握温度、浓度对反应速率的影响及氧化铝、Al与酸的反应为解答的关键,侧重分析能力的考查,题目难度不大.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 | |
| B. | 锅炉中沉积的CaSO4可用饱和碳酸钠溶液浸泡,再用盐酸溶解而除去 | |
| C. | 将AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 | |
| D. | 加热Fe2(SO4)3溶液,Fe3+的水解程度和溶液的pH均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 六水氯化钙属于混合物 | B. | 葡萄糖注射液不能产生丁达尔效应 | ||
| C. | 食盐水属于浊液 | D. | 氯化铵不属于盐类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (2)(4) | C. | (1)(4)(5) | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是含有碳元素的化合物都属于有机物 | |
| B. | 大多数有机物都是由分子构成的 | |
| C. | 有机物都很容易燃烧 | |
| D. | 易溶于汽油、酒精、苯等有机溶剂中的物质,一定是有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极,被氧化 | B. | 负极,被还原 | C. | 正极,被还原 | D. | 正极,被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com