
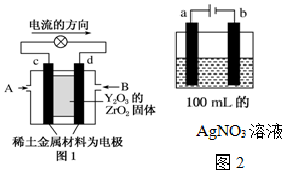
 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-═2O2-).
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-═2O2-).分析 (1)依据装置图中电流流向分析,c为正极,氧气的电子发生还原反应,d为负极,甲烷失电子发生氧化反应;
(2)图2中a为阳极,阳极上氢氧根离子失电子生成氧气,b为阴极,阴极上银离子得电子生成Ag,据电极反应式计算反应生成氢离子物质的量和浓度,反应时溶液中减少的是Ag和O元素,所以要加入Ag2O才能恢复到电解前的状态.
解答 解:(1)图1是原电池,依据电流流向是从正极流向负极,c电极为正极,氧气得到电子发生还原反应,d电极为电池负极,甲烷失电子发生还原反应,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子,负极电极反应为:CH4+4O2-═CO2+2H2O+8e-;
故答案为:负极;CH4+4O2-═CO2+2H2O+8e-;
(2)图2中a为阳极,阳极上氢氧根离子失电子生成氧气,a电极上的电极反应式为4OH--4e-═2H2O+O2↑,b为阴极,阴极上银离子得电子生成Ag;若a电极产生560mL(标准状况)气体,即生成氧气为0.025mol,则反应生成氢离子物质的量为0.1mol,所以氢离子浓度为1mol/L;电解时溶液中减少的是Ag和O元素,所以要加入Ag2O才能恢复到电解前的状态,由4AgNO3+2 H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3可知,Ag2O为0.05mol;
故答案为:4OH--4e-═2H2O+O2↑;1mol/L;a;0.05mol.
点评 本题考查了原电池和电解池原理,根据电流的流向判断原电池,再结合各个电极上发生的电极反应分析解答,难点是电极反应式的书写,题目难度中等,侧重于考查学的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
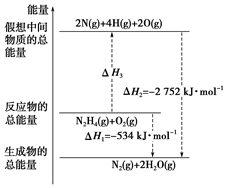 肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示.已知断裂1mol 化学键所需的能量(kJ):N≡N 为942、O=O为500、N-N为154,则断裂1mol N-H 键所需的能量(kJ)是( )
肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示.已知断裂1mol 化学键所需的能量(kJ):N≡N 为942、O=O为500、N-N为154,则断裂1mol N-H 键所需的能量(kJ)是( )| A. | 194 | B. | 391 | C. | 516 | D. | 685 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
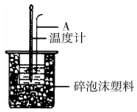 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下: | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
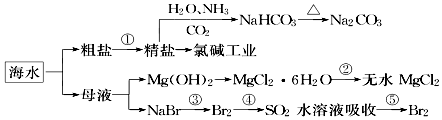 海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )| A. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 制取NaHCO3的反应是利用其溶解度相对较小 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题:
某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com