
分析 设NO2与SO2的物质的量分别为1mol、2mol,容器体积为1L,则
NO2(g)+SO2(g)?SO3(g)+NO(g)
开始 1 2 0 0
转化 x x x x
平衡 1-x 2-x x x
达到平衡时SO3的体积分数为25%,则$\frac{x}{1-x+2-x+x+x}$×100%=25%,解得x=0.75mol/L,
结合K为生成物浓度幂之积与反应物浓度幂之积的比计算.
解答 解:设NO2与SO2的物质的量分别为1mol、2mol,容器体积为1L,则
NO2(g)+SO2(g)?SO3(g)+NO(g)
开始 1 2 0 0
转化 x x x x
平衡 1-x 2-x x x
达到平衡时SO3的体积分数为25%,则$\frac{x}{1-x+2-x+x+x}$×100%=25%,解得x=0.75mol/L,
该反应的平衡常数K=$\frac{0.75×0.75}{0.25×1.25}$=1.8,
故答案为:1.8.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K及体积分数的计算为解答的关键,侧重分析与计算能力的考查,注意利用平衡浓度计算K,题目难度不大.


科目:高中化学 来源: 题型:解答题
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的相差4 |
| F 是前四周期原子电子排布图中单电子数最多的元素 |
| G在周期表的第十一列 |
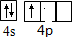 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
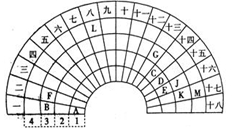 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
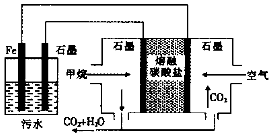
| A. | Fe电极的电极反应式为:Fe-2e-═Fe2+ | |
| B. | 通入空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32- | |
| C. | 通入甲烷的石墨电极的电极反应式为:CH4+100H+-8e-═CO32-+7H2O | |
| D. | 为增强污水的导电能力,可向污水中加入适量工业用食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 | B. | ll | C. | 13 | D. | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事实或现象 | 结论 |
| A | 某钾盐中滴加盐酸,产生使澄清石灰水变浑浊的无色气体 | 该钾盐是K2CO3或KHCO3 |
| B | 由淀粉得到葡萄糖 | 发生了水解反应 |
| C | 常温下,向相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中的铝片先溶解完 | 反应物的浓度越大,反应速率越快 |
| D | NH3沸点低于PH3 | 结构和组成相似的物质,沸点随相对分子质量增大而升高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
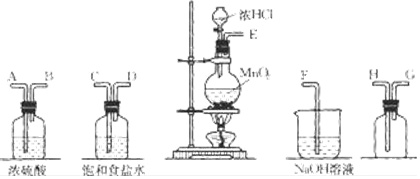
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com