
【题目】常温下联氨(N2H4)的水溶液中有:
① N2H4+H2O![]() N2H5++OH- K1
N2H5++OH- K1
② N2H5++H2O![]() N2H62++OH- K2 ,
N2H62++OH- K2 ,
该溶液中的微粒的物质的量分数δ(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是

A. 图中Ⅲ对应的微粒为N2H62+
B. 反应②为N2H5+的水解平衡方程式
C. 若C点为N2H5C1溶液,则存在:c(Cl-)>c(N2H5+ )+2c(N2H62+)
D. 据A点可求:K1=10-6
【答案】B
【解析】
横坐标为OH-浓度的负对数值,从左到右OH-的浓度越来越小,越能促进N2H4电离,纵坐标为微粒的物质的量分数δ(X),故Ⅰ对应的微粒为N2H4,Ⅱ对应的微粒为N2H5+,Ⅲ对应的微粒为N2H62+。
A.Ⅲ对应的OH-的浓度最小,N2H4电离平衡正向移动的程度最大,则Ⅲ对应的微粒为N2H62+,A项正确;
B. 反应②为N2H4的二级电离方程式,B项错误;
C. 由电荷守恒的:c(OH-)+c(Cl-)=c(N2H5+ )+2c(N2H62+)+c(H+),从图像可得C点c(OH-)<c(H+),故c(Cl-)>c(N2H5+ )+2c(N2H62+),C项正确;
D. 从图像可得A点N2H4、N2H5+物质的量分数相等,说明它们的浓度相等,c(OH-)=![]() ,
,![]() =
=![]() =
=![]() =
=![]() ,D项正确。
,D项正确。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
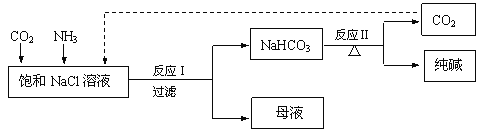
已知反应I为:NaCl + CO2 + NH3 + H2O === NaHCO3↓+ NH4Cl
(1)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42等离子。
① 为得到纯净的饱和NaCl溶液,进行了如下操作。请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中加入过量___________________(填试剂名称),过滤;
c.向滤液中加入过量___________________(填试剂名称),过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
② 步骤c中反应的离子方程式是______________________。
(2)反应II的化学方程式是_________________________。
(3)制得的纯碱中含有少量NaCl。取5.5 g纯碱样品加入足量稀硫酸,得到标准状况下1120 mL CO2。则样品中纯碱的质量分数是_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:

(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O ⅱ: ......
写出ⅱ的离子方程式:____________________________________________。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_______(填离子符号)。
(3)氧化过程中被MnO2氧化的物质有(写化学式):____________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_____________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从2019年烧到2020年的澳大利亚山火终于熄灭了,在此次火灾中产生了大量的大气污染物:①浓烟中的炭粒 ②氮的氧化物 ③碳的氧化物 ④硫的氧化物,其中会导致雨水酸化的有害、有毒气体是
A.①③B.②④C.③④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是

A. 甲、乙中电解质溶液的pH都增大
B. 理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
C. 乙中电解MgCl2溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D. 甲中A处通入CH4,电极反应式为CH4+10OH--8e- =![]() +7H2O
+7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将尿酸钠(NaUr)悬浊液静置,取上层清液,再通入HCl,溶液中尿酸的浓度c(HUr)与pH 的关系如图所示。已知:Ksp(NaUr)=4.9×10-5,Ka(HUr)=2.0×10-6。下列说法正确的是

A. 上层清液中,c(Ur-) = 7.0×10-2 mol·L-1
B. 在M→N 的变化过程中,c(Na+) c(Ur-)的值将逐渐减小
C. 当c(HUr) = c(Ur-)时,c(Cl-)>c(Ur-)
D. 当pH=7 时,2c(Na+) = c(Ur-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某热电厂用脱硫得到的石膏(CaSO42H2O)生产K2SO4肥料的流程如图:

请回答下列问题:
(1)石膏中S的化合价是___,试画出S2-的离子结构示意图___,请写出脱硫过程的化学方程式2CaCO3+2SO2+O2+4H2O=2CaSO42H2O+2__。
(2)石膏与饱和(NH4)2CO3溶液相混合,发生反应Ⅰ时需不断搅拌,其目的是__。
(3)实验室完成过滤操作所需要用到玻璃棒,玻璃棒的作用是____。
(4)该工艺可以循环利用的物质有____,副产品NH4Cl农业生产中可用作___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com