
【题目】下列离子方程式书写正确的是
A. 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体: Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. NaHCO3溶液与过量的Ba(OH)2溶液混合:2HCO3-+Ba2++2OH-══ BaCO3 ↓+2H2O+CO32-
C. 向FeBr2溶液中通入过量的Cl2:2Fe2++4Br-+3Cl2══ 2Fe3++2Br2+6Cl-
D. 向AlCl3溶液中滴加过量氨水: Al3++4NH3·H2O ══ AlO2-+4NH4++2H2O
【答案】C
【解析】
向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体,生成的不是氢氧化铁沉淀;NaHCO3溶液与过量的Ba(OH)2溶液混合生成碳酸钡和氢氧化钠;向FeBr2溶液中通入过量的Cl2, Fe2+、Br-完全被氧化;AlCl3溶液中滴加过量氨水生成氢氧化铝沉淀和氯化铵。
向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体,生成的不是氢氧化铁沉淀,离子方程式是Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,故A错误;NaHCO3溶液与过量的Ba(OH)2溶液混合: HCO3-+Ba2++OH-═BaCO3↓+H2O,故B错误;向FeBr2溶液中通入过量的Cl2, Fe2+、Br-完全被氧化,反应离子方程式是2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C正确;向AlCl3溶液中滴加过量氨水:Al3++3NH3·H2O═Al(OH)3↓+3NH4+,故D错误。故选C。
Fe(OH)3(胶体)+3H+,故A错误;NaHCO3溶液与过量的Ba(OH)2溶液混合: HCO3-+Ba2++OH-═BaCO3↓+H2O,故B错误;向FeBr2溶液中通入过量的Cl2, Fe2+、Br-完全被氧化,反应离子方程式是2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C正确;向AlCl3溶液中滴加过量氨水:Al3++3NH3·H2O═Al(OH)3↓+3NH4+,故D错误。故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】关于常温下浓度均为0.1 mol·Lˉ1的盐酸和醋酸溶液,下列说法正确的是
A. c(CH3COOˉ)=c(Clˉ)
B. 醋酸溶液的pH小于盐酸
C. 醋酸的电离方程式:CH3COOH=CH3COOˉ+H+
D. 等物质的量浓度、等体积的盐酸与氢氧化钠溶液混合后溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种重要材料的中间体,结构简式为:![]() 。合成M的一种途径如下:
。合成M的一种途径如下:
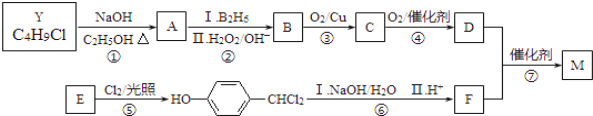
A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去.
已知:①Y的核磁共振氢谱只有1种峰;
②RCH=CH2 ![]() RCH2CH2OH;
RCH2CH2OH;
③两个羟基连接在同一个碳原子上不稳定,易脱水: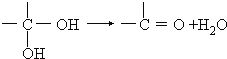
请回答下列问题:
(1)Y的结构简式是________,D的官能团名为________。
(2)步骤①的化学反应方程式是________。
(3)步骤⑤的反应类型是________。
(4)写出步骤⑥中第Ⅰ步化学反应方程式是________。
(5)下列说法不正确的是________。
a.A和E都能发生氧化反应 b.1molB完全燃烧需6mol O2
c.C能与新制氢氧化铜悬浊液反应 d.1molF最多能与3mol H2反应
(6)M经催化氧化得到X(C11H12O4),X的同分异构体中同时满足下列条件的结构简式为________。
a.苯环上只有两个取代基,苯环上的一氯代物有2种
b.水解只生成芳香醇和二元酸,且二元酸的核磁共振氢谱只有2种峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁,在形成晶体时会结晶一定量的水;在工农业生产中具有重要用途,如照相的显影剂,生产磷酸铁锂电池的原料等。
已知:①草酸亚铁不溶于水,可溶于酸;②Fe(SCN)63-+3C2O42-=Fe(C2O4)33-+6SCN-。
回答下列问题:
Ⅰ.甲同学检查药品发现该晶体显浅黄色,认为晶体不纯,可能是因为部分的铁被氧化。为验证自己的猜想,进行实验验证。取少量的晶体样品溶于稀硫酸,滴加KSCN溶液,溶液无明显变化。由此认为晶体中不存在+3价的铁。你认为_______(填“正确”或“不正确”),理由是___________________________________。
Ⅱ.乙同学为测定草酸亚铁晶体FeC2O4﹒xH2O中的结晶水含量,利用如下装置:
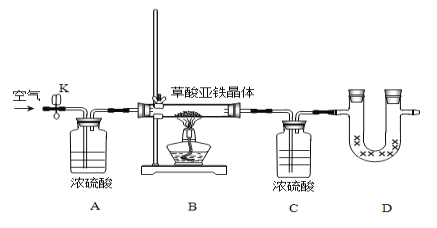
①做实验前首先要_____________________________;
②称取一定质量的晶体,装好药品,开始实验接下来的实验步骤依次为____________________,重复实验直至B中恒重。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K d.打开K,缓缓通入空气 e.冷却至室温 f.称量
Ⅲ.丙同学用滴定的方法也可以测定草酸亚铁晶体中结晶水的含量。取a克草酸亚铁晶体溶入稀硫酸,再把所得溶液稀释成500mL,取出50mL放入锥形瓶,向其中逐滴滴入未知浓度的酸性KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,且有气泡冒出,当溶液颜色突变成浅紫色,停止滴加。接着向溶液中加入稍过量的KI溶液和几滴淀粉溶液,然后再用c mol/L的Na2S2O3溶液滴至终点。几次实验平均耗用Na2S2O3溶液VmL。(2Na2S2O3+I2=Na2S4O6+2NaI)
(1)写出向溶液中滴加酸性KMnO4溶液发生反应的离子方程式_____________________
(2)上述试验中稀释草酸亚铁溶液时除烧杯和玻璃棒外,还必需的玻璃仪器有__________
(3)x=_______________
(4)若实验中滴入KMnO4溶液过多,则所得x值___________(填偏大、偏小或无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(为验证卤素单质氧化性的相对强弱,某学习小组用如图所示装置进行实验![]() 夹持仪器已略去,气密性已检验
夹持仪器已略去,气密性已检验![]() .
.
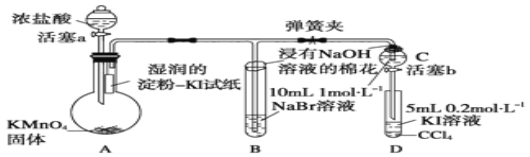
实验过程:
Ⅰ![]() 打开弹簧夹,打开活塞a,滴加浓盐酸.
打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ![]() 当B和C中的溶液都变为黄色时,夹紧弹簧夹.
当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ![]() 当B中溶液由黄色变为棕红色时,关闭活塞a.
当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.......
(1)A中产生黄绿色气体,其电子式是 ______ ;写出实验室制取A中气体的化学方程式___________________
(2)验证氯气的氧化性强于碘的实验现象是 ________________________________ .
(3)B中溶液发生反应的离子方程式是 ____________________________________ .
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 ___________________________ .
(5)过程Ⅲ实验的目的是 _________________________________________.
(6)实验结论:氯、溴、碘单质的氧化性逐渐 ______,原因是:同主族元素从上到下,原子半径逐渐______,得电子能力逐渐______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是有关生活中的醋酸,其中主要利用了醋酸酸性的是( )
①醋酸不小心滴到大理石桌面上,桌面失去光泽 ②熏醋可一定程度上防治流行性感冒 ③醋可以除去水壶中的水垢 ④用醋烹饪鱼,除去鱼的腥味
A.①③
B.②④
C.①④
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】180℃时将0.5 mol H2和1 mol CO2通入1 L的恒容密闭容器中,反应生成甲醇蒸汽(CH3OH)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示,下列说法中正确的是

A. 该反应的化学方程式:2CO2+4H2![]() 2CH3OH+O2
2CH3OH+O2
B. 在0~3 min内H2的平均化学反应速率为0.1 mol·L-1·min-1
C. 当容器内混合气体密度不再变化时,表明反应已经达到平衡状态
D. 在3~10 min内,反应仍未达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用恰当的分离混合物的方法,下列做法中正确的是
A. 分离KNO3和碘的固体混合物:四氯化碳,分液
B. 除去AgI胶体中混有的I-离子:过滤、洗涤、干燥
C. 分离食用油和水:分液
D. 从溴水中分离溴:蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com