
| A. | KCl、Na2SO4 | B. | KCl、Na2SO4、NaCl | ||
| C. | NaCl、Na2SO4、K2SO4 | D. | KCl、K2SO4、Na2SO4 |
分析 可以根据物质的量浓度的定义式来求出它们物质的量的比,然后根据电荷守恒确定物质的量的比进行判断.
解答 解:溶液中c(Na+)=2c(SO42-),c(K+)=c(Cl-),可以求得离子物质的量之比为2:1:1:1.
A、Na2SO4、KCl按照1:1混合,符合要求,故A正确;
B、KCl、Na2SO4、NaCl无论按照何种比例混合,离子数都不符合,故B不符合;
C、Na2SO4、K2SO4、NaCl无论按照何种比例混合,离子数都不符合,故C不符合;
D、KCl、Na2SO4、K2SO4无论按照何种比例混合都不符合离子数之比,故D不符合.
故选A.
点评 本题考查了离子浓度间的关系,关键是明确解题思路要根据电荷守恒和物质的量的浓度解答,题目较难.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | |||||
| 其他 | 阳离子 核外无电子 | 无机非金属材料的主角 | 焰色反 应呈黄色 |
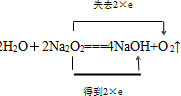 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
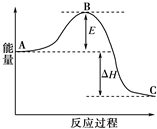 氮元素的氢化物和氧化物在工业生产和防建设中都有广泛的应用.请回答下列问题:
氮元素的氢化物和氧化物在工业生产和防建设中都有广泛的应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验内容 | 实验结果 |
| a | 加AgNO3溶液 | 有白色沉淀生成 |
| b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准 状况下的体积) |
| c | 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次 称量读数为2.33g |
| 阴离子符号 | 物质的量浓度(mol•L-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
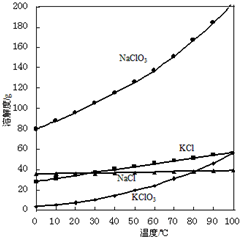 以NaCl等为原料制备KClO4的过程如下:
以NaCl等为原料制备KClO4的过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1 | B. | 1.5 mol•L-1 | C. | 4 mol•L-1 | D. | 7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2↓ | |
| B. | NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)3↓+NH3•H2O | |
| C. | Fe3++2SO42-+2Ba2++3OH-=2BaSO4↓+Fe(OH)3↓ | |
| D. | 3NH4++Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+Fe(OH)3↓+3NH3•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com