
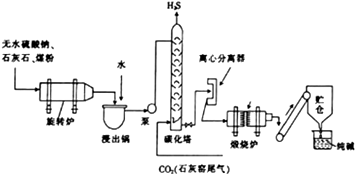
 历史上路布兰法生产纯碱的工艺流程如图所示.
历史上路布兰法生产纯碱的工艺流程如图所示.分析 (1)由食盐与浓硫酸强热反应生成硫酸钠和氯化氢;
(2)CaCO3、Na2CO3、煤在旋转炉中反应产生的气体有碳的氧化物等;
(3)石灰窑尾气通入碳化塔中产生硫化氢;H2S可制硫磺、硫酸等物质;
(4)利用离心力将溶液中密度不同的成分进行分离的一种设备.
(5)高温下,碳酸氢钠不稳定易分解;
(6)产生CO污染空气,不能连续生产纯碱.
解答 解:(1)食盐与浓硫酸强热反应的化学方程式为2NaCl+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑,
故答案为:2NaCl+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑;Na2CO3;
(2)CaCO3、Na2CO3、煤在旋转炉中反应产生的气体有CO2、CO等,固体产物主要为CaS和Na2CO3,
故答案为:CO2、CO;Na2CO3;
(3)碳化塔中产生硫化氢的方程式:CaS+CO2+H2O=CaCO3+H2S,H2S可制硫磺、硫酸等物质,
故答案为:CaS+CO2+H2O=CaCO3+H2S;制硫磺、硫酸等物质;
(4)物质密度越大离心力越大,用离心分离器进行固液分离,
故答案为:进行固液分离;
(5)碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、水和二氧化碳,反应方程式为 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(6)路布兰法是利用食盐晶体和浓硫酸在高温下反应生成硫酸钠和氯化氢,再利用C与石灰石和硫酸钠高温加热生成碳酸钠及碳的氧化物,CO污染空气,又不能连续生产;
故答案为:CO污染空气,又不能连续生产.
点评 化学来源于生产、生活,又服务于生产、生活,本题很好的体现了这一理念;该题涉及化学方程式的书写,反应类型的判断等知识,要根据相关知识细心分析解答.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
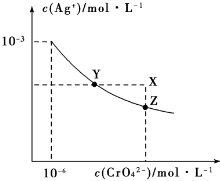 t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点 | |
| B. | 在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃ | |
| C. | 向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点 | |
| D. | 在t℃时,Ag2CrO4的Ksp为1×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①④⑤ | C. | ①②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

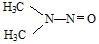 所示,1molNDMA分子中含有σ键的数目为10mol.
所示,1molNDMA分子中含有σ键的数目为10mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com