
【题目】下列有关叙述正确的是
A.现有CO、CO2、O3三种气体,它们都含有1molO,则三种气体的物质的量之比为3:2:1
B.相同条件下,同体积、同密度的C2H4和N2,两种气体的分子数一定相等
C.28gCO和22.4LCO2中含有的碳原子数一定相等
D.配制450mL0.1mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8g
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1mol/L的是( )
A. 将58.5g NaCl溶解在1L水中
B. 将1L 10mol/L的硫酸加入9L水中
C. 将11.2L HCl气体溶于水配成0.5L溶液
D. 将40g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500 mL 0.2 mol/L的Na2SO4溶液,实验操作步骤有:
A.在天平上称出14.2 g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。
B.把制得的溶液小心地转移到容量瓶中。
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)________。
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是 _______、_______、 _______。
(3)下列情况会使所配溶液浓度偏高的是(填序号)______。
a.没进行上述的操作步骤D
b.加蒸馏水时,不慎超过了刻度线
c.砝码上沾有杂质
d.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 8 g S4中,含有质子数为8NA
B. 1 L pH=l的稀H2SO4中,含有H+数目为0.2 NA
C. 甲烷氯代反应中,消耗l mol Cl2生成HCl分子数为NA
D. 密闭容器中,2 mol NO和lmolO2充分反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。

已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II相关金属离子形成氢氧化物沉淀的pH范围如下:
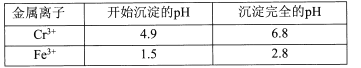
回答下列问题:
(l)滤渣②的主要成分为____(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式____。
(3)“加热”操作的目的是____。
(4)“酸化”过程中发生反应2CrO42-+2H+![]() Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-l (NH4)2Fe(SO4)2 标准溶液滴定,滴定终点消耗标准溶液的体积为9.00 mL,则产品的纯度为____。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如下图所示。

①负极的电极反应式为____;
②一段时间后,中间室中NaCl溶液的浓度____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O

(1)请回答:甲池是________________装置,B(石墨)电极的名称是_____________________。
(2)写出下列电极反应式:通入CH3OH的电极的电极反应式是___________________________,A(Fe)电极的电极反应式为___________________________。
(3)乙池中反应的化学方程式为___________________________。
(4)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗标准状况下的氧气___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列与“物质的量”相关的计算。
(1)标准状况下,33.6LCO2的物质的量为___mol,质量为___g,所含O原子的数目是____个。
(2)同温同压下,同体积的氨(NH3)和硫化氢(H2S)气体的质量之比是____,同质量的氨和硫化氢气体所含氢原子个数之比是___。
(3)agCl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,50mL 0.10mol/L的醋酸中存在着如下平衡:CH3COOH ![]() CH3COO―+H+。若分别作如下改变,对上述平衡有何影响
CH3COO―+H+。若分别作如下改变,对上述平衡有何影响
(1)加入少量冰醋酸,平衡将_______________________,溶液中c(H+)将________________;
(2)加入一定量蒸馏水,平衡将__________________,溶液中c(H+)将__________;
(3)加入少量0.10mol/L盐酸,平衡将________________,溶液中c(H+)将_________________;
(4)加入20 mL 0.10mol/L的NaOH溶液,平衡将__________________,溶液中c(H+)将__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种已投入生产的大型蓄电系统。电解质通过泵不断地在储罐和电池间循环;电池中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;图中左边的电解质为Na2S2、Na2S4,右边电解质为NaBr3、NaBr。充、放电时发生的反应为:Na2S4+3NaBr![]() 2Na2S2+NaBr3,下列说法正确的是
2Na2S2+NaBr3,下列说法正确的是
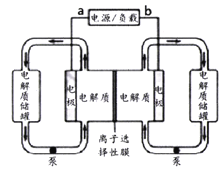
A. 充电时b端为电源负极
B. 在放电过程中钠离子通过离子选择膜的流向为从右到左
C. 电池充电时,阴极的电极反应为S42-+2e-=2S22-
D. 以此蓄电池为电源电解精炼铜,当有0.1 mol e-转移吋时,阳极有3.2g铜溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com