
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 2.8gN2和CO的混合气体中所含质子数为1.4NA | |
| C. | 235g${\;}_{92}^{235}$U发生裂变反应${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为9NA | |
| D. | 50mL12mol/L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
分析 A、H218O与D2O的摩尔质量均为20g/mol,且均含10个中子;
B、氮气和CO的摩尔质量均为28g/mol,且两者均含14个质子;
C、92235U+01n$\stackrel{裂变}{→}$3890Sr+54136U+1001n净产生的中子为10-1=9个;
D、二氧化锰中和浓盐酸反应.
解答 解:A、H218O与D2O的摩尔质量均为20g/mol,故2.0g混合物的物质的量为0.1mol,且均含10个中子,故0.1mol混合物中含NA个中子,故A正确;
B、氮气和CO的摩尔质量均为28g/mol,故2.8g混合物的物质的量为0.1mol,且两者均含14个质子,故0.1mol混合物中含1.4NA个质子,故B正确;
C、92235U+01n$\stackrel{裂变}{→}$3890Sr+54136U+1001n净产生的中子为10-1=9个,则235g核素92235U发生裂变反应净产生的中子(01n)数为9NA,故C正确;
D、二氧化锰中和浓盐酸反应,故浓盐酸不能反应完全,则转移的电子数小于0.3NA个,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.32 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:X>Y>Z | B. | 非金属性:X<Y<Z | ||
| C. | 原子半径:X<Y<Z | D. | 原子得电子能力:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2、CaCl2 | B. | CO2、CH4 | C. | NH4Cl、NaOH | D. | NaF、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
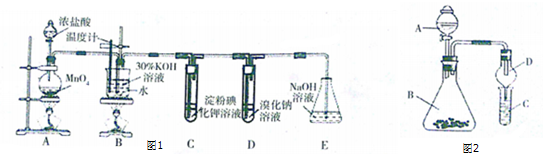
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
碳及其化合物在研究和生产中有许多重要用途.请回答下列问题: .
.| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
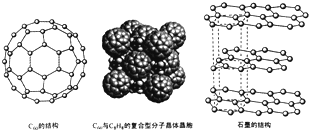
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用氯化铝溶液和氨水制氢氧化铝:Al3++3OH-=Al(OH)3↑ | |
| B. | Al与NaOH水溶液反应产生气体:Al+OH-+2H2O=Al(OH)3↓+2H2↑ | |
| C. | 用盐酸除铜锈[Cu2(OH)2CO3]:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑ | |
| D. | FeCl3溶液与Cu反应:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气以液态形式存在时可称为氯水或液氯 | |
| B. | 红热的铜丝在氯气中燃烧,冒蓝色烟 | |
| C. | 有氯气参加的化学反应必须在溶液中进行 | |
| D. | 钠在氯气中燃烧生成白色固体氯化钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com