
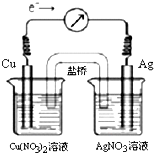
 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )| c2(Ag+) |
| c(Cu2+) |
| c2(Ag+) |
| c(Cu2+) |
| c2(Ag+) |
| c(Cu2+) |
| c2(Ag+) |
| c(Cu2+) |
| c(Cu2+) |
| c2(Ag+) |
| c2(Ag+) |
| c(Cu2+) |
| c2(Ag+) |
| c(Cu2+) |
| c2(Ag+) |
| c(Cu2+) |
| c(Cu2+) |
| c2(Ag+) |
| c(Cu2+) |
| c2(Ag+) |
| c(Cu2+) |
| c2(Ag+) |
| c2(Ag+) |
| c(Cu2+) |


科目:高中化学 来源: 题型:
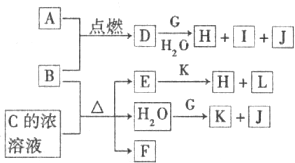
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
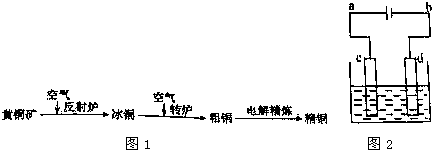
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市丰台区高三上学期期末考试化学试卷(解析版) 题型:选择题
将反应Cu (s) +
2Ag+ (aq)  Cu2+
(aq) + 2Ag (s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是
Cu2+
(aq) + 2Ag (s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是

A.KNO3盐桥中的K+移向Cu(NO3)2溶液
B.当电流计指针为0时,该反应达平衡,平衡常数K=0
C.若此时向AgNO3溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转
D.若此时向Cu(NO3)2溶液中加入NaOH固体,随着NaOH量的增加电流计指针向右偏转幅度减小→指针指向0→向左偏转
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com