
·ÖĪö £Ø1£©øł¾ŻµēŗÉŹŲŗć£ŗc£ØNa+£©+2c£ØMg2+£©+c£ØNH4+£©+c£ØH+£©=c£ØCl-£©+2c£ØSO42-£©£»
£Ø2£©øł¾ŻpH=-lgc£ØH+£©¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©øł¾ŻµēŗÉŹŲŗć£ŗc£ØNa+£©+2c£ØMg2+£©+c£ØNH4+£©+c£ØH+£©=c£ØCl-£©+2c£ØSO42-£©£¬Ōņ£ŗ
1.5”Į10-4mol/L+2”Į4.0”Į10-5mol/L+1.8”Į10-4mol/L+c£ØH+£©=4.0”Į10-4mol/L+2”Į1.0”Į10-5mol/L
½āµĆ£ŗc£ØH+£©=1.0”Į10-5 mol/L£¬
¹Ź“š°øĪŖ£ŗ1.0”Į10-5 mol/L£»
£Ø2£©øĆČÜŅŗµÄpH=-lg1.0”Į10-5=5£¬¹Ź“š°øĪŖ£ŗ5£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄĮæÅØ¶Č¼ĘĖć”¢ČÜŅŗpHÖµ¼ĘĖć£¬ÄŃ¶Č²»“ó£¬×¢Ņāµē½āÖŹ»ģŗĻČÜŅŗÖŠ³£ĄūÓƵēŗÉŹŲŗć¼ĘĖćĄė×ÓÅØ¶Č£®


 Ó¢²Åµć½ņĻµĮŠ“š°ø
Ó¢²Åµć½ņĻµĮŠ“š°ø ŗģ¹ū×ÓČż¼¶²āŹŌ¾ķĻµĮŠ“š°ø
ŗģ¹ū×ÓČż¼¶²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | pH=6.8µÄČÜŅŗ | |
| B£® | ³£ĪĀĻĀ£¬ÓÉĖ®µēĄėµÄOH-Ąė×ÓÅضČĪŖ1”Į10-13 mol/L | |
| C£® | ¼ÓČė·ÓĢŖ£¬²»ĻŌŗģÉ«µÄČÜŅŗ | |
| D£® | ³£ĪĀĻĀ£¬ČÜŅŗÖŠµÄH+Ąė×ÓÅضČĪŖ5”Į10-7 mol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚNa2CO3ČÜŅŗÖŠ£ŗc£ØNa+£©£ŗc£ØCO32-£©=2£ŗ1 | |
| B£® | ŌŚ25”ꏱ£¬ĪŽĀŪŹĒĖįŠŌ”¢¼īŠŌ»ņÖŠŠŌČÜŅŗÖŠ£¬Ęäc£ØH+£©ŗĶc£ØOH-£©µÄ³Ė»ż¶¼µČÓŚ1”Į10-14 | |
| C£® | 0.1mol/LµÄKOHČÜŅŗŗĶ0.1mol/L°±Ė®ÖŠ£¬c£ØOH-£©ĻąµČ | |
| D£® | Ōµē³ŲµÄÕż¼«Ėł·¢ÉśµÄ·“Ó¦ŹĒŃõ»Æ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NH3”¢Cl2”¢H3PO4 | B£® | AgCl”¢Ba£ØOH£©2”¢H2S | ||
| C£® | H2SO3”¢NaOH”¢H2SO4 | D£® | NH3•H2O”¢H2O”¢CH3COOH |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | A13+”¢NO3-”¢Fe2+ | B£® | SCN-”¢Cl-”¢Fe3+ | C£® | HCO3-”¢Al3+”¢Cl- | D£® | Na+”¢K+”¢CO32- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ²»ÄÜøśĖį·“Ó¦µÄŃõ»ÆĪļŅ»¶ØÄÜøś¼ī·“Ó¦ | |
| B£® | Ķ¬Ņ»Ö÷×åŌŖĖŲµÄĒā»ÆĪļ£¬Ļą¶Ō·Ö×ÓÖŹĮæŌ½“ó£¬ĖüµÄ·ŠµćŅ»¶ØŌ½øß | |
| C£® | ŌŚCCl4”¢PCl3”¢HClÖŠø÷Ō×Ó×īĶā²ć¾łÄÜ“ļµ½8µē×ÓĪČ¶Ø½į¹¹ | |
| D£® | ÉżøßĪĀ¶ČæÉŅŌ¼Óæģ·“Ó¦ĖŁĀŹ£¬ĘäÖ÷ŅŖŌŅņŹĒ·“Ó¦Īļ·Ö×ÓÄÜĮæŌö¼Ó£¬»ī»Æ·Ö×Ó°Ł·ÖŹżµÄŌö¼Ó£¬Ź¹ÓŠŠ§Åöײ“ĪŹżŌö¼Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
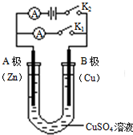 ČēÓŅĶ¼ĖłŹ¾£¬Ēė°“ŅŖĒó»Ų“šĻĀĮŠĪŹĢā£®
ČēÓŅĶ¼ĖłŹ¾£¬Ēė°“ŅŖĒó»Ų“šĻĀĮŠĪŹĢā£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
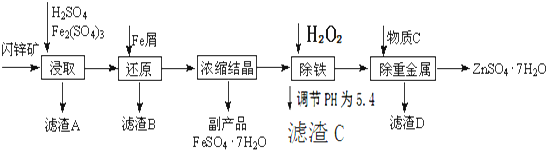

²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com