
【题目】下列有关现象及对应的离子方程式或化学反应方程式不正确的是
A.草酸溶液可使酸性高锰酸钾溶液褪色:MnO4-+C2O42-+16H+=Mn2++2CO2↑+8H2O
B.在酸性环境中不存在 S2O32-:S2O32-+2H+=S↓+SO2↑+H2O
C.K2Cr2O7在水中存在平衡:Cr2O72-+H2O![]() 2CrO42-+2H+,可由溶液颜色判断其酸碱性
2CrO42-+2H+,可由溶液颜色判断其酸碱性
D.SOCl2是一种液态化合物,遇水有雾及刺激性气味气体产生,其化学反应方程式为
SOCl2+H2O=2HCl↑+SO2↑
【答案】A
【解析】
试题分析:A.草酸是无色溶液,酸性高锰酸钾溶液为紫色,所以草酸能使酸性高锰酸钾溶液褪色,其离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故A错误;B.S2O32-能与H+反应生成硫沉淀和二氧化硫及水,其反应的离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O,故B正确;C.K2Cr2O7在酸性时为橙色,在碱性时为黄色,所以K2Cr2O7在水中存在平衡:Cr2O72-+H2O2CrO42-+2H+可由溶液颜色判断其酸碱性,故C正确;D.SOCl2能与水反应生成二氧化硫和氯化氢,其化学反应方程式为:SOCl2+H2O=2HCl↑+SO2↑,故D正确;故选A。


科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。
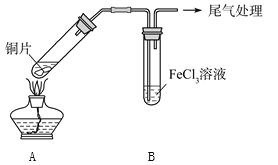
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A |
FeCl3溶液显酸性的原因是__________________。写出装置A中产生SO2的化学方程式:_______________________________。
(2)当SO2通入FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】[Fe(HSO3)]2+为红棕色,它可以将Fe3+还原为Fe2+。生成
[Fe(HSO3)]2+的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色[Fe(HSO3)]2+的原因:_________________________。
写出溶液中[Fe(HSO3)]2+与Fe3+反应的离子方程式: ________________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤②、③的实验。
步骤② | 往5 mL 1 mol·L-1FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色 |
步骤③ | 往5 mL重新配制的1 mol·L-1FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为____________________。
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物[Fe(HSO3)]2+;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料。用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
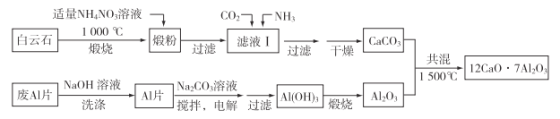
(1)煅粉主要含MgO和____________,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶;若滤液Ⅰ中c(Mg2+)小于5×10-6 mol·L-1,则溶液pH大于________[Mg(OH)2的Ksp=5×10-12];该工艺中不能用(NH4)2SO4代替NH4NO3,原因是_________________。
(2)滤液Ⅰ中的阴离子有________(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成_________________,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为____________。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为____________。
(5)一种可超快充电的新型铝电池,充放电时AlCl![]() 和Al2Cl
和Al2Cl![]() 两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为__________________________________。
两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,将放出的气体通入足量的澄清石灰水中,充分反应后得到的沉淀的质量是l.0g,加热后剩余的固体物质与足量的稀盐酸反应,收集到1.12L气体(标准状况).则原固体混合物中NaHCO3的物质的量为_______,Na2CO3的质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.5.4 g Al分别与含溶质0.2 mol的NaOH溶液、盐酸反应,生成H2的分子数均为0.3NA
B.5.35 g NH4Cl固体中含有N—H键的个数为0.4NA
C.将含有1 mol FeCl3的浓溶液全部制成胶体,含Fe(OH)3胶粒的数目为NA
D.120 g熔融的NaHSO4中含阳离子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com