
【题目】(1)合成高分子化合物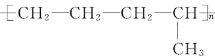 的单体是______;(写结构简式)
的单体是______;(写结构简式)
(2)1mol乳酸( ![]() )最多消耗_______molNa;两分子乳酸在浓硫酸加热的条件下,可生成一种环状酯,写出此酯的结构简式:__________;
)最多消耗_______molNa;两分子乳酸在浓硫酸加热的条件下,可生成一种环状酯,写出此酯的结构简式:__________;
(3)有机物M的结构简式为: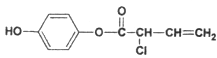 ,则:1 mol M最多消耗的H2、Br2的物质的量比值为_________________;1 mol M最多消耗NaOH的物质的量为______________mol.
,则:1 mol M最多消耗的H2、Br2的物质的量比值为_________________;1 mol M最多消耗NaOH的物质的量为______________mol.
【答案】CH2═CH-CH3 CH2═CH2 2 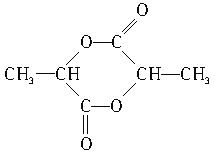 4:3 4
4:3 4
【解析】
(1)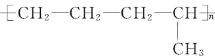 为加聚反应产物,链节的主链上含有4个C原子,且不会碳碳双键,则其单体为两种,从主链中间断开后,再分别将两个半键闭合即得单体为:CH2═CH-CH3、CH2═CH2;
为加聚反应产物,链节的主链上含有4个C原子,且不会碳碳双键,则其单体为两种,从主链中间断开后,再分别将两个半键闭合即得单体为:CH2═CH-CH3、CH2═CH2;
(2)羟基及羧基均能与钠反应,故1mol乳酸( ![]() )最多消耗2molNa;
)最多消耗2molNa;![]() 的官能团为羟基、羧基,浓硫酸加热条件下两分子的
的官能团为羟基、羧基,浓硫酸加热条件下两分子的![]() 能反应生成六元环状化合物,则该化合物的结构简式为
能反应生成六元环状化合物,则该化合物的结构简式为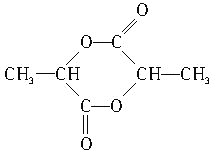 ;
;
(3)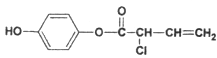 分子中碳碳双键和苯环都能和氢气在一定条件下发生加成反应,所以1mol M与足量H2加成,消耗H2 4mol;分子中只有碳碳双键能和溴水发生加成反应,而酚中酚羟基的邻、对位上的氢能与溴发生取代反应,所以1mol M与足量溴水混合,消耗Br2的物质的量为3mol,故1 mol M最多消耗的H2、Br2的物质的量比值为:4:3;
分子中碳碳双键和苯环都能和氢气在一定条件下发生加成反应,所以1mol M与足量H2加成,消耗H2 4mol;分子中只有碳碳双键能和溴水发生加成反应,而酚中酚羟基的邻、对位上的氢能与溴发生取代反应,所以1mol M与足量溴水混合,消耗Br2的物质的量为3mol,故1 mol M最多消耗的H2、Br2的物质的量比值为:4:3;
M中酯基及酚羟基、氯原子均能与氢氧化钠反应,故1 mol M最多消耗NaOH的物质的量为4mol。


科目:高中化学 来源: 题型:
【题目】10mL某气态烯烃在50mLO2里充分燃烧,得到液态水和体积为35mL的混合气体(同温同压下测定),该气态烯烃是( )
A. 乙烯B. 丙烯C. 1-丁烯D. 2-丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制两种一定物质的量浓度的 NaOH溶液。请回答:
(1)①容量瓶上不出现的标识是___(填写字母,下同)
A.容积 B.压强 C.温度 D.密度 E.刻度线
②容量瓶所具备的功能有___。
A.可以长期贮存配制好的溶液 B.可以用来加热溶解固体溶质
C.可以用来作气体发生装置 D.配制一定体积准确浓度的标准溶液
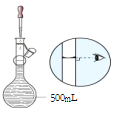
(2)用 NaOH固体配制480mL1mol·L-1NaOH溶液,用托盘天平称取___gNaOH固体。如图为配制过程的某一步操作,该操作名称是___。
(3)该同学用上述 1mol·L-1NaOH溶液配制 250mL0.1mol·L-1的 NaOH溶液。下列仪器中不必要用到的有___。
①天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管
(4)该同学在两次配制中,以下操作使所配溶液的物质的量浓度偏大的是___。
A.准取称取 NaOH固体,待溶解后立即转移到 100mL容量瓶中并定容
B.定容并摇匀,容量瓶正立后发现液面低于刻度线,继续加蒸馏水定容
C.用少量的 1mol·L-1NaOH溶液洗涤 250mL容量瓶 2~3次
D.向容量瓶中加水至超过刻度线,用胶头滴管吸出后再定容至 100mL。
(5)若向容量瓶中转移溶液时不慎有溶液溅出,处理方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2 ![]() CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验 序号 | 温度/℃ | 初始CCl4的浓度 (mol·L-1) | 初始H2的浓度 (mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | A |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为_____________。
②实验1中,CCl4的转化率A________50%(填“大于”“小于”或“等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为________________。
④实验3中,B的值________(填序号)。
A 等于50% B 大于50% C 小于50% D 从本题资料无法判断
(2)120 ℃时,在相同条件的密闭容器中,分别进行H2 的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。

①在图中的四条线中,表示H2的起始浓度为2 mol·L-1的实验消耗CCl4的百分率变化曲线的是________(填序号)。
②根据上图曲线,氢气的起始浓度为________ mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)烷烃A在同温、同压下蒸气的密度是H2的36倍,其分子式为___________。
(2)写出天然橡胶单体(2-甲基-1,3-丁二烯)的结构简式_________。
(3)立方烷![]() 的一氯代物有_________种,它的六氯代物有_________种。
的一氯代物有_________种,它的六氯代物有_________种。
(4)下列物质的沸点按由高到低的顺序排列正确的是___________。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③ (CH3)3CH ④ (CH3)2CHCH2CH3
A.②④①③ B. ④②①③ C.④③②① D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A.检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B.检验试液中的NH4+:试液![]() 气体
气体![]() 试纸变蓝
试纸变蓝
C.检验试液中的I-:试液![]() 黄色溶液
黄色溶液![]() 深黄色溶液
深黄色溶液
D.检验试液中的Fe2+:试液![]() 无明显现象
无明显现象![]() 红色溶液
红色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
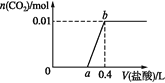
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2(SO4)3溶液可用于腐蚀绝缘板上的铜箔,制造印刷电路板。现设计了一个方案如下,从腐蚀后的废液(主要含Fe3+、Fe2+、Cu2+)中回收铜,并重新获得Fe2(SO4)3溶液。
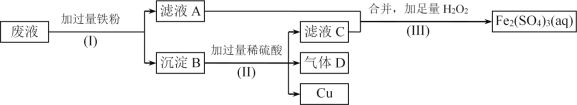
(1)步骤(I)中分离操作名称为____________________。
(2)沉淀B的主要成分有____________________,气体D的电子式为__________。
(3)写出步骤(III)中发生反应的离子方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
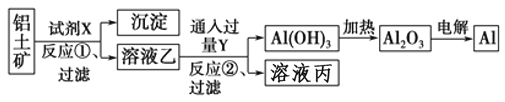
下列叙述正确的是
A. 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氧化铁
C. 图中所有的转化反应都不是氧化还原反应
D. 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com