
| t/min | 2 | 4 | 7 | 9 |
| n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A�� | 0��2 min��ƽ������v��Z��=2.0��10-3 mol•L-1•min-1 | |
| B�� | �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ v��������v���棩 | |
| C�� | ���¶��´˷�Ӧ��ƽ�ⳣ��K=144 | |
| D�� | �����������䣬�ٳ���0.2 mol Z��ƽ��ʱX������������� |
���� A��2min��Y���ʵ����仯Ϊ0.16mol-0.12mol=0.04mol������v=$\frac{\frac{��n}{V}}{��t}$����v��Y��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��Z����
B���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������Ӧ�ƶ�����Ӧ�ﵽ��ƽ��ǰv���棩��v��������
C���ɱ������ݿ�֪7minʱ����Ӧ����ƽ�⣬����ƽ��ʱY�����ʵ�������������ʽ����ƽ��ʱ������ֵ����ʵ��������ڷ�Ӧ���������Ļ�ѧ��������ȣ������ʵ�������Ũ�ȴ���ƽ�ⳣ������ʽ���㣻
D����ͨ��0.2 mol Z����ЧΪ��ԭƽ�����������ѹǿ����Ӧǰ�������������䣬ƽ�ⲻ�ƶ���
��� �⣺A��2min��Y���ʵ����仯Ϊ0.16mol-0.12mol=0.04mol��Ũ�ȱ仯��Ϊ0.04mol��10L=0.004mol/L������v��Y��=0.002mol/��L•min��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��Z��=2v��Y��=2��0.002mol/��L•min��=0.004mol/��L•min������A����
B���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������Ӧ�ƶ�����Ӧ�ﵽ��ƽ��ǰv���棩��v����������B����
C���ɱ������ݿ�֪7minʱ����Ӧ����ƽ�⣬ƽ��ʱY�����ʵ���Ϊ0.10mol����
X��g��+Y��g��?2Z��g��
��ʼ����mol��0.16 0.16 0
�仯����mol��0.06 0.06 0.12
ƽ������mol��0.1 0.1 0.12
���ڷ�Ӧǰ������������ȣ������ʵ�������Ũ�Ƚ��м��㣬�ʻ�ѧƽ�ⳣ��K=$\frac{0.1{2}^{2}}{0.1��0.1}$=1.44����C����
D����ͨ��0.2 mol Z����ЧΪ��ԭƽ�����������ѹǿ�����ڷ�Ӧǰ�������������䣬ƽ�ⲻ�ƶ���X������������䣬��D��ȷ��
��ѡD��
���� ���⿼�黯ѧ��Ӧ���ʡ���ѧƽ�ⳣ������ѧƽ���Ӱ�����صȣ��Ѷ��еȣ�ע��Cѡ���жԻ�ѧƽ�ⳣ�������⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Li��Be��Bԭ�������������������� | |
| B�� | P��S��ClԪ����������������� | |
| C�� | N��O��Fԭ�ӵõ����������� | |
| D�� | Na��K��Rb�ĵ��Ӳ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
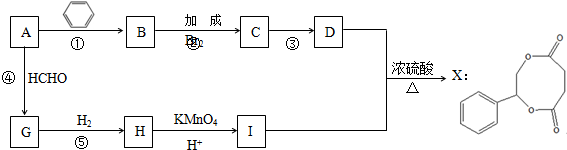
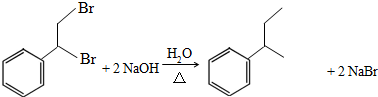 ��
��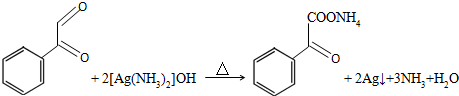 ��
��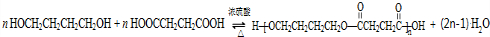 ��
�� ����2�֣�
����2�֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
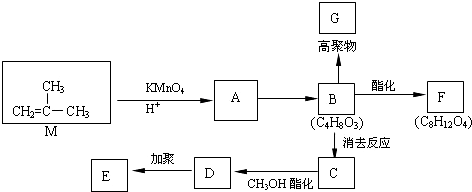
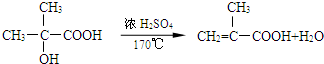 ����D��E�Ļ�ѧ����ʽ
����D��E�Ļ�ѧ����ʽ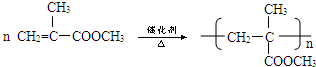 ��
�� ��
��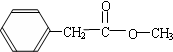 �ȣ�
�ȣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �ɶ�����Ԫ����ɵļס��Һͱ���Ϊ��ѧ�������ʣ�һ�������£�����ת����ϵ����$\stackrel{ǿ����Һ}{��}$��$\stackrel{ǿ����Һ}{��}$��
�ɶ�����Ԫ����ɵļס��Һͱ���Ϊ��ѧ�������ʣ�һ�������£�����ת����ϵ����$\stackrel{ǿ����Һ}{��}$��$\stackrel{ǿ����Һ}{��}$���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ﮡ��ơ��ء�﨡�虜����м��ԣ��ʳ�Ϊ����� | |
| B�� | ʯ��ʯ�����С�մ�̼������ȶ�����ǿ���Ǵ��� | |
| C�� | ��������Ͷ�뵽����̼������Һ���ܲ�����ɫ���������ܲ������� | |
| D�� | ����Li���ܶ���С�ļ�������۵����Rb |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

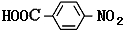 ��
��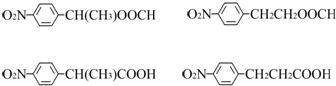 ����2�֣�
����2�֣�
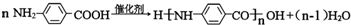 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| X��Һ | ���� |  | |
| A | ϡHNO3�ữ��AgNO3��Һ | �а�ɫ�������� | |
| B | ����KSCN��FeSO4��Һ | ��Һ��ΪѪ��ɫ | |
| C | ����KI������Һ | ��Һ��Ϊ��ɫ | |
| D | ��ɫʯ����Һ | ��Һ�ȱ�����ɫ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com