
| 36000C |
| 1.6×10 -19C |
| 2.25×10 23 |
| 6.02×10 23 |
| ||
| x+y |
| 2 |
| 36000C |
| 1.6×10 -19C |
| 2.25×10 23 |
| 6.02×10 23 |
| ||
| x+y |
| 2 |
|


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

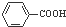 和
和 为原料制备
为原料制备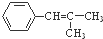 的合成路线流程图(无机试剂任用).合成路线流程图示例如图:
的合成路线流程图(无机试剂任用).合成路线流程图示例如图:| NaOH溶液 |
| △ |
| CH3COOH |
| 浓硫酸△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓碱飞溅到皮肤上,应立刻涂上硫酸溶液 |
| B、金属钠着火,立刻用水扑灭 |
| C、加热试管前,先来回移动酒精灯加热,再对准药品集中加热 |
| D、氢气还原氧化铜,先加热固体,再通入氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若无铜析出,则溶液中有Fe2+、Cu2+存在,Fe3+也可能存在 |
| B、若无铜析出,则溶液中有Fe2+、Cu2+存在,Fe3+不可能存在 |
| C、若有铜析出,则溶液中只有Fe2+,不可能有Cu2+、Fe3+存在 |
| D、若有铜析出,则溶液中有Fe2+存在,也可能有Cu2+,但无Fe3+存在. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有非极性共价键 |
| B、键角均为109.5° |
| C、有两种同分异构体 |
| D、分子属于极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com