

| A.①②③④ | B.只有②③④ | C.只有①②③ | D.只有②③ |
科目:高中化学 来源: 题型:
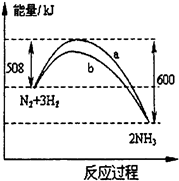
 (2009?静安区一模)一个化学反应一般都有旧化学键的破坏和新化学键的形成.在一定条件下,氮气与氢气合成氨气的能量变化的曲线如图(a是没有使用催化剂的反应历程,b是使用了催
(2009?静安区一模)一个化学反应一般都有旧化学键的破坏和新化学键的形成.在一定条件下,氮气与氢气合成氨气的能量变化的曲线如图(a是没有使用催化剂的反应历程,b是使用了催 2NH3(g)+92kJ
2NH3(g)+92kJ查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | C-F | 427 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一个化学反应一般都有旧化学键的破坏和新化学键的形成.在一定条件下,氮气与氢气合成氨气的能量变化的曲线如图(a是没有使用催化剂的反应历程,b是使用了催化剂的反应历程),下列叙述正确的是( )
一个化学反应一般都有旧化学键的破坏和新化学键的形成.在一定条件下,氮气与氢气合成氨气的能量变化的曲线如图(a是没有使用催化剂的反应历程,b是使用了催化剂的反应历程),下列叙述正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)化学键的键能是指气态原子间形成1mol化学键时释放的能量。如H(g)+I(g)→H-I(g) ΔH ==+297KJ即H-I键的键能为297KJ?mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。一个化学反应一般都有旧化学键的破坏和新化学键的形成。
下表是一些键能数据(KJ?mol-1):
| 键能 |
| 键能 |
| 键能 |
| 键能 |
H-H | 436 | H-F | 565 | C-F | 427 | C-O | 347 |
H-O | 464 | H-Cl | 432 | C-Cl | 330 | Cl-Cl | 243 |
H-S | 339 |
|
| C-I | 218 | S=S | 255 |
回答下列问题:
(1)由表中数据能否得出这样的结论:
①半径越小的原子形成的共价键越牢固(即键能越大)_______(填“能”或“不能”)
②非金属性越强的原子形成的共价键越牢固________(填“能”或“不能”)。
能否从数据找出一些规律,请写出一条:_________________ _______________;试预测C-Br键的键能范围_________<C-Br键能<__________。
(2)由热化学方程式H2(g)+Cl2(g)=2HCl(g);△H= ―185KJ?mol-1并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是___________________________,由热化学方程式2H2(g)+S2(s)=2H2S(g);△H=-224.5KJ?mol-1和表中数值可计算出1mol S2(s)气化时将________(填“吸收”或“放出”)_______KJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是一些键能数据(kJ·mol-1)
化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
H—H | 436 | Cl—Cl | 243 | H—Cl | 432 | H—O | 464 |
S=S | 255 | H—S | 339 | C—F | 427 | C—O | 347 |
C—Cl | 330 | C—I | 218 | H—F | 565 |
|
|
回答下列问题:
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)____________(填“能”或“不能”);②非金属性越强的原子形成的共价键越牢固____________(填“能”或“不能”)。能否从数据找出一些规律,请写出一条:____________;试预测C—Br键的键能范围:____________<C—Br键能<____________。
(2)由热化学方程式H2(g)+Cl2(g)====2HCI(g);ΔH=-185kJ·mol-1,并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是__________________________________________,由热化学方程式2H2(g)+S2(s)=2H2S(g);ΔH=-224.5kJ·mol-1和表中数值可计算出lmolS2(s)气化时将____________(填“吸收”或“放出”)____________kJ的热量。
(3)卤代烃RX在同样条件下发生碱性水解反应时,RF、RCl、RBr、RI(R相同)的反应活性由大到小的顺序是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com