

| 第一次 | 第二次 | 第三次 | |
| 体积(mL) | 16.10mL | 16.60mL | 15.90mL |
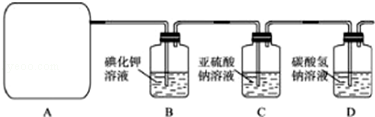
分析 (1)由仪器结构特征,可知仪器A为三颈烧瓶;
(2)根据草酸的回收率最高时判断最佳反应温度;浓硫酸、硝酸具有强氧化性,可以氧化草酸;
(3)草酸易溶于乙醇和水,微溶于乙醚,且乙醚易挥发,用乙醚洗涤;
(4)①酸性条件下高锰酸钾将草酸氧化为二氧化碳,自身被还原为锰离子;
②A.配制标准液时,若KMnO4不纯(杂质不与待测液反应),消耗高锰酸钾溶液体积偏大;
B.润洗滴定管时,不需要加满所需的酸或碱液,导致药品的浪费;
C.滴定时,眼睛注视锥形瓶,观察溶液颜色变化,判断反应终点;
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使消耗高锰酸钾溶液的体积读数偏大;
③由于酸性高锰酸钾溶液显紫红色,草酸反应完毕,滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红,反应到达终点;
④第2次数据与其它两次相差较大,应舍弃,其它两次平均值为消耗酸性高锰酸钾溶液体积,根据n=cV计算反应中消耗高锰酸钾的物质的量,根据方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O计算25mL草酸的物质的量,再计算原样品中草酸的物质的量,进而计算草酸晶体的纯度.
解答 解:(1)由仪器结构特征,可知仪器A为三颈烧瓶,
故答案为:三颈烧瓶;
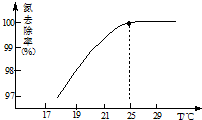
(2)根据图3可知,在温度为70℃时,草酸的收率最高,所以选择的最佳反应温度是70℃,
浓硫酸、硝酸具有强氧化性,可以氧化草酸,混酸滴加过快或温度过高,将导致草酸产率下降,
故答案为:70℃;草酸易被浓硫酸或硝酸氧化;
(3)草酸易溶于乙醇和水,微溶于乙醚,且乙醚易挥发,用乙醚洗涤,
故答案为:乙醚;易挥发,无残留;
(4)①酸性条件下高锰酸钾将草酸氧化为二氧化碳,自身被还原为锰离子,反应离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
根据草酸溶液的酸碱性及量取溶液的精确度选用相应的仪器;
②A.配制标准液时,若KMnO4不纯(杂质不与待测液反应),消耗高锰酸钾溶液体积偏大,使实验误差偏偏高,故A错误;
B.润洗滴定管时,不需要加满所需的酸或碱液,导致药品的浪费,故B错误;
C.滴定时,眼睛注视锥形瓶,观察溶液颜色变化,判断反应终点,故C正确;
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使消耗高锰酸钾溶液的体积读数偏大,会使实验误差偏高,故D正确.
故选:CD;
③由于酸性高锰酸钾溶液显紫红色,所以滴定终点的判断依据是:向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色,
故答案为:向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色;
④第2次数据与其它两次相差较大,应舍弃,消耗酸性高锰酸钾溶液体积为$\frac{(16.10+15.90)mL}{2}$=16.00mL,反应中消耗高锰酸钾的物质的量是0.016L×0.1mol/L=0.0016mol,根据方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,可知25mL溶液中草酸的物质的量是0.0016mol×$\frac{5}{2}$=0.004mol,因此原样品中草酸的物质的量是0.004mol×$\frac{250mL}{25mL}$=0.04mol,则质量=0.04mol×126g/mol=5.04g,所以草酸的纯度是$\frac{5.04g}{10.0g}$×100%=50.4%.
故答案为:50.4%.
点评 本题考查有机物制备实验方案设计,涉及化学仪器、对装置的分析评价、实验条件的选择控制、物质含量的测定、氧化还原反应滴定等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 L氨气体分解成1 L氮气与3 L氢气吸收92 kJ热量 | |
| B. | 1 mol氮气与3 mol氢气反应生成2 mol液态氨放出的热量小于92 kJ | |
| C. | 25℃和101kPa时,2 molNH3(g)完全分解为1 mol N2(g)和3 mol H2(g )吸热92KJ | |
| D. | 3个氢气分子与1个氮气分子反应生成2个氨气分子放出92 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 、
、 .
. 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水蒸气通过灼热的铁粉 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 将Zn片放入CuSO4溶液 | D. | 铝与MnO2发生铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com