
|
将3.3 g CO2通入含有3.7 g Ca(OH)2的澄清石灰水中,可得沉淀 | |
| [ ] | |
A. |
7.5 g |
B. |
5 g |
C. |
2.5 g |
D. |
0.5 g |
科目:高中化学 来源:2012届福建省厦门外国语学校高三11月月考化学试卷 题型:实验题
(14分)某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2%NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):
请根据题目要求回答下列问题: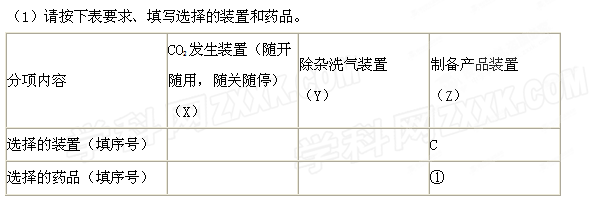
(2)如何检验所选择的CO2发生装置(X)的气密性,请写出主要操作过程: 。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为 ,Y装置中除去的杂质为 。
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其原因是 ;通入 过量CO2后,Z装置内的溶液中离子浓度大小顺序为 ;若要保证乙装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过 %(质量分数)。
过量CO2后,Z装置内的溶液中离子浓度大小顺序为 ;若要保证乙装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过 %(质量分数)。
附:有关物质在常温(20℃)时的溶解度
| 化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
| 溶解度(g/100gH2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)![]() CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) △H=-393.5kJ?mol-1
H2(g)+![]() O2(g)=H2O(g) △H=-242.0kJ?mol-1
O2(g)=H2O(g) △H=-242.0kJ?mol-1
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ?mol-1
O2(g)=CO2(g) △H=-283.0kJ?mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸汽反应的热化学方程式:
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和比1molC(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图:

并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是 (填“甲”或“乙”);判断的理由是
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述 (填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |

①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 (填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和
20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1
NaHCO3溶液混合,实验测得产生的气体体积(V)
随时间(t)的变化如右图所示:反应初始阶段
两种溶液产生CO2气体的速率存在明显差异的原因是
。
反应结束后所得两溶液中,c(CH3COO—) c(SCN—)
(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。

a. c(CH3COO-) b. c(H+)
c. Kw d. 醋酸电离平衡常数
(2)右图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别
在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属
阳离子浓度变化情况。如果向三种沉淀中加盐酸,最
先溶解的是 (填化学式)。向新生成的ZnS浊液
中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS
沉淀会转化为 (填化学式)沉淀。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷
燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:
请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时, 极增重________g
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
依照阿伏加德罗定律,下列叙述正确的是
( ) A.同温同压下两种气体的体积之比等于摩尔质量之比。
B.同温同压下两种气体的物质的量之比等于密度之比。 C.同温同压下两种气体的摩尔质量之比等于密度之比。D.同温同体积下两种气体的物质的量之比等于压强之比。
设NA表示阿伏加德罗常数,下列说法不正确的是 ( )
A. 醋酸的摩尔质量与NA个醋酸分子的质量在数值上相等。
B.标准状况下,以任意比混和的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2 NA。
C.1L1mol/LCuCl2溶液中含有的Cu2+的个数为NA。
D.25℃,1.01×105Pa时,16g臭氧所含的原子数为NA。
设NA表示阿伏加德罗常数的数值,下列说法正确的是 ( )
A.用惰性电极电解500mL饱和食盐水时,若溶液的pH值变为14时,则电极上转移的电子数目为NA。
B.在标准状况下,各为1mol的二氧化硫、三氧化硫的体积均约为22.4L。
C. 在常温常压下,6g石英晶体中,含有0.4NA个硅氧共价键。
D.120g由NaHSO4和KHSO3组成的混合物中含有硫原子NA个。
标准状况下,下列混合气体的平均式量可能是50的是 ( )
A.硫化氢和二氧化硫 B.一氧化氮和氧气
C.二氧化硫和溴化氢 D.碘化氢和氯气
在一个恒容密闭容器中充入11gX气体(摩尔质量为 44g·mol-1),压强为1×105pa。如果保持温度不变,继续充入X气体,使容器内压强达到5×105pa。则此时容器内的气体X的分子数约为 ( )
A.3.3×1025 B.3.3×1024 C.7.5×1023 D.7.5×1022
由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同。则该混合气体中二氧化碳、氢气、一氧化碳的体积比为 ( )
A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.26∶16∶57
同温、同压下,CO2 和NO的混合气体 20mL,通过足量过氧化钠后气体体积减少到10mL,则原混合气体的体积比可能是 ( )
A.1∶1 B.2∶3 C.3∶2 D.1∶4
乙炔和乙烯的混合气体完全燃烧时,所需氧气的体积是原混合气体的2.7倍,则该混合气体与足量的H2发生加成反应时,消耗H2的体积是原混合气体体积的 ( ) A.1.6倍 B.1.8倍 C.1.4倍 D.1.2倍
在一定条件下,将5体积NO、5体积NO2、6体积O2混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体的体积是 ( )
A.1体积 B.2体积 C.3体积 4.4体积
19世纪,化学家对氧化锆的化学式有争议.经测定锆的相对原子质量为91,其氯化物蒸气的密度是同溶、同压下H2密度的116-117倍,试判断与氯化物价态相同的氧化锆的化学式 ( )
A.ZrO B.Zr2O C.Zr2O3 D.ZrO2
常温下,向20L真空容器中通入A mol硫化氢和 Bmol氯气(A,B均为不超过5的正整数),反应完全后,容器内气体可能达到的最大密度是 ( )
A.8.5 g·L-1 B.18.25g·L-1 C.18.5 g·L-1 D.35.5 g· L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com