
| A、500mL 1mol/L的KNO3溶液 |
| B、500mL 1mol/L的Ba(NO3)2溶液 |
| C、1000mL 0.5mol/L的Mg(NO3)2溶液 |
| D、1L 0.5mol/L的Fe(NO3)3溶液 |


科目:高中化学 来源: 题型:
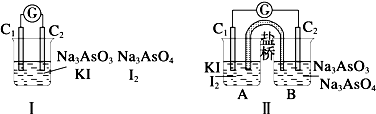
| A、甲组操作时,电流计(G)指针发生偏转 |
| B、乙组操作时,C1上发生的电极反应为 I2+2e-═2I- |
| C、甲组操作时,溶液颜色变浅 |
| D、乙组操作时,C2做正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| I |
| II |
| 催化剂 |
| 时间(s) | 0 | 2 | 4 | 6 | 8 | 10 |
| n(NO)(mol) | 0.4 | 0.32 | 0.26 | 0.22 | 0.20 | 0.20 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m=n | B、m>n |
| C、m<n | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制取蒸馏水时,为了防止瓶内产生暴沸现象,应向烧瓶内加入几片碎瓷片 |
| B、用胶头滴管向试管中滴加液体时,胶头滴管紧贴试管内壁 |
| C、蒸馏时,冷却水应从冷凝器下端进入 |
| D、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、①③④ |
| C、①②④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com