


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| A、能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色 |
| B、装置C的作用是吸收SO2尾气,防止污染空气 |
| C、为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2,产生白色沉淀 |
| D、为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、64g SO2中含有的氧原子数为2NA |
| B、含有6.02×1023个H原子的H2在标准状况下的体积约为22.4L |
| C、40g NaOH溶解在1L水中,所制得的溶液,物质的量浓度为1mol?L-1 |
| D、标准状况下,11.2L H2O含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol氧含有6.02×1023个微粒 |
| B、阿伏加德罗常数数值约等于6.02×1023 |
| C、钠的摩尔质量等于它的相对原子质量 |
| D、1mol任何气体所含的气体分子数目,不一定都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
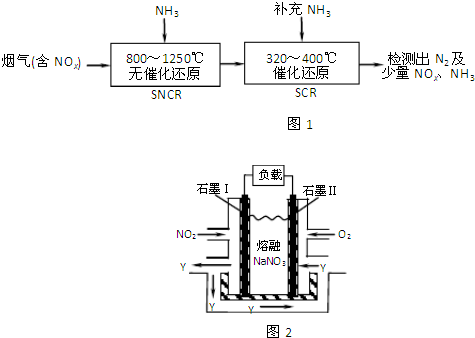
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com