
”¾ĢāÄæ”æA”¢B”¢C”¢D”¢E”¢FĮłÖÖ¶ĢÖÜĘŚŌŖĖŲ£¬AŌŖĖŲµÄĄė×ÓŃęÉ«·“Ó¦ĪŖ»ĘÉ«”£5.8 g BµÄĒāŃõ»ÆĪļĒ”ŗĆÄÜÓė100 mL 2 mol”¤L”Ŗ1ŃĪĖįĶźČ«·“Ó¦£»BŌ×ÓŗĖÖŠÖŹ×ÓŹżŗĶÖŠ×ÓŹżĻąµČ”£F2ŌŚ»ĘĀĢÉ«ĘųĢåC2ÖŠČ¼ÉÕ²śÉś²Ō°×É«»šŃę”£DŌŖĖŲŌ×ÓµÄ×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµē×ÓŹżµÄ3±¶£»ŗ¬EŌŖĖŲµÄ»ÆŗĻĪļŌŚŹĒ×ŌČ»½ēÖÖĄą×ī¶ą”£øł¾ŻÉĻŹöĢõ¼ž»Ų“š£ŗ
£Ø1£©CŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆ £¬Ęä×īøß¼ŪĪŖ ”£AµÄŌ×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ £»
£Ø2£©A”¢D”¢FŠĪ³É»ÆŗĻĪļ£¬Ęäµē×ÓŹ½ĪŖ £¬øĆĪļÖŹŗ¬ÓŠµÄ»Æѧ¼üĄąŠĶĪŖ £»
£Ø3£©ŹµŃéŹŅÖĘČ”C2µÄĄė×Ó·½³ĢŹ½ĪŖ £»
£Ø4£©ÓƵē×ÓŹ½±ķŹ¾BC2µÄŠĪ³É¹ż³Ģ £»
£Ø5£© ŗ¬EŌŖĖŲµÄ»ÆŗĻĪļŌŚ×ŌČ»½ēÖÖĄą×ī¶ąµÄŌŅņŹĒ £»
£Ø6£© ŌŖĖŲD”¢E·Ö±šŗĶF¹¹³É10e-·Ö×ÓĆū³ĘŹĒ ”¢ ”£
”¾“š°ø”æ£Ø1£©µŚČżÖÜĘŚµŚ¢÷A×壬+7£¬![]() £»
£»
£Ø2£©![]() £¬Ąė×Ó¼ü”¢£Ø·Ē¼«ŠŌ£©¹²¼Ū¼ü£»
£¬Ąė×Ó¼ü”¢£Ø·Ē¼«ŠŌ£©¹²¼Ū¼ü£»
£Ø3£©MnO2+ 4H++ 2Cl-![]() Mn2++ Cl2”ü+ 2H2O£»
Mn2++ Cl2”ü+ 2H2O£»
£Ø4£©![]() £»
£»
£Ø5£©¢Ł.Ģ¼Ō×ÓÖ®¼ä½įŗĻµÄ¶ąŃłŠŌ£ØĢ¼Į“£¬Ģ¼»·£©£»¢Ś.Ģ¼Ō×ӳɼü·½Ź½µÄ¶ąŃłŠŌ£ØĢ¼Ģ¼µ„¼ü£¬Ė«¼ü£¬Čž¼ü£»¢Ū.Ķ¬·ÖŅģ¹¹Ģå µÄ“ęŌŚ£»
£Ø6£©Ė®£¬¼×Ķ锣
”¾½āĪö”æŹŌĢā·ÖĪö£ŗF2ŌŚ»ĘĀĢÉ«ĘųĢåC2ÖŠČ¼ÉÕ²śÉś²Ō°×É«»šŃę£¬¼“F2ĪŖH2£¬C2ĪŖCl2£¬DŌŖĖŲŌ×ÓµÄ×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµē×ÓŹżµÄ3±¶£¬ŌņDĪŖ£ŗO£¬ŗ¬EµÄ»ÆŗĻĪļµÄŹĒ×ŌČ»½ēÖÖĄą×ī¶ąµÄ£¬ŌņE£ŗC£¬AµÄŌŖĖŲµÄŃęÉ«·“Ó¦ĪŖ»ĘÉ«£¬ŌņAĪŖNa£¬BĪŖMg£¬£Ø1£©CŌŚÖÜĘŚ±ķÖŠĪ»ÖĆĪŖ£ŗµŚČżÖÜĘŚVIIA×壬Ö÷×åŌŖĖŲ×īøß¼Ū=ĖłŌŚ×åŠņŹż£ØO”¢F³żĶā£©£¬×īøß¼ŪĪŖ+7¼Ū£¬NaµÄŌ×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ![]() £»£Ø2£©Na”¢H”¢OČżÕß¹¹³ÉŹĒNaOH£¬ŹōÓŚĄė×Ó»ÆŗĻĪļ£¬Ęäµē×ÓŹ½ĪŖ£ŗ
£»£Ø2£©Na”¢H”¢OČżÕß¹¹³ÉŹĒNaOH£¬ŹōÓŚĄė×Ó»ÆŗĻĪļ£¬Ęäµē×ÓŹ½ĪŖ£ŗ![]() £¬ŗ¬ÓŠ»Æѧ¼üĪŖĄė×Ó¼üŗĶ¼«ŠŌ¹²¼Ū¼ü£»£Ø3£©ŹµŃéŹŅÖʱøĀČĘų£¬ÓĆMnO2ŗĶÅØŃĪĖį·“Ó¦Öʱø£¬ĘäĄė×Ó·“Ó¦·½³ĢŹ½ĪŖ£ŗMnO2+ 4H++ 2Cl-
£¬ŗ¬ÓŠ»Æѧ¼üĪŖĄė×Ó¼üŗĶ¼«ŠŌ¹²¼Ū¼ü£»£Ø3£©ŹµŃéŹŅÖʱøĀČĘų£¬ÓĆMnO2ŗĶÅØŃĪĖį·“Ó¦Öʱø£¬ĘäĄė×Ó·“Ó¦·½³ĢŹ½ĪŖ£ŗMnO2+ 4H++ 2Cl-![]() Mn2++ Cl2”ü+ 2H2O£»£Ø4£©ĀČ»ÆĆ¾ŹĒĄė×Ó»ÆŗĻĪļ£¬Ęä¹ż³ĢĪŖ£ŗ
Mn2++ Cl2”ü+ 2H2O£»£Ø4£©ĀČ»ÆĆ¾ŹĒĄė×Ó»ÆŗĻĪļ£¬Ęä¹ż³ĢĪŖ£ŗ![]() £»£Ø5£©¢Ł.Ģ¼Ō×ÓÖ®¼ä½įŗĻµÄ¶ąŃłŠŌ£ØĢ¼Į“£¬Ģ¼»·£©£»¢Ś.Ģ¼Ō×ӳɼü·½Ź½µÄ¶ąŃłŠŌ£ØĢ¼Ģ¼µ„¼ü£¬Ė«¼ü£¬Čž¼ü£»¢Ū.Ķ¬·ÖŅģ¹¹Ģå µÄ“ęŌŚ£»£Ø6£©Ė®£¬¼×Ķ锣
£»£Ø5£©¢Ł.Ģ¼Ō×ÓÖ®¼ä½įŗĻµÄ¶ąŃłŠŌ£ØĢ¼Į“£¬Ģ¼»·£©£»¢Ś.Ģ¼Ō×ӳɼü·½Ź½µÄ¶ąŃłŠŌ£ØĢ¼Ģ¼µ„¼ü£¬Ė«¼ü£¬Čž¼ü£»¢Ū.Ķ¬·ÖŅģ¹¹Ģå µÄ“ęŌŚ£»£Ø6£©Ė®£¬¼×Ķ锣



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³ŃŠ¾æŠŌѧĻ°Š”×éÓūÓĆ»Æѧ·½·Ø²āĮæŅ»øö²»¹ęŌņČŻĘ÷µÄĢå»ż”£°Ń35.1 g NaCl·ÅČė 500 mLÉÕ±ÖŠ£¬¼ÓČė150 mLÕōĮóĖ®”£“żNaClĶźČ«Čܽāŗ󣬽«ČÜŅŗČ«²æ×ŖŅʵ½ČŻĘ÷ÖŠ£¬ÓĆÕōĮóĖ®Ļ”ŹĶÖĮĶźČ«³äĀśČŻĘ÷”£“ÓÖŠČ”³öČÜŅŗ100 mL£¬øĆČÜŅŗĒ”ŗĆÓė 20 mL 0.100 mol”¤L-1 AgNO3ČÜŅŗĶźČ«·“Ó¦”£ŌņøĆČŻĘ÷µÄĢå»żĪŖ
A£®30 L B£®20 L C£®10 L D£®40 L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”放»Æѧ”Ŗ”ŖŃ”ŠŽ2»ÆѧÓė¼¼Źõ”æĮņ»ÆŠæ£ØZnS£©ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬ÄŃČÜÓŚĖ®£¬æÉÓÉĮ¶ŠæµÄ·ĻŌüŠæ»ŅÖĘČ”£¬Ę乤ŅÕĮ÷³ĢČēĻĀĶ¼ĖłŹ¾”£

£Ø1£©ĪŖĢįøߊæ»ŅµÄ½žČ”ĀŹ£¬æɲÉÓƵķ½·ØŹĒ £ØĢīŠņŗÅ£©”£
¢ŁŃŠÄ„ ¢Ś¶ą“Ī½žČ” ¢ŪÉżøßĪĀ¶Č ¢Ü¼ÓŃ¹ ¢Ż½Į°č
£Ø2£©²½Öč¢ņĖłµĆĀĖŌüÖŠµÄĪļÖŹŹĒ £ØŠ“»ÆѧŹ½£©”£
£Ø3£©²½Öč¢óÖŠæɵĆCdµ„ÖŹ£¬ĪŖ±ÜĆāŅżČėŠĀµÄŌÓÖŹ£¬ŹŌ¼ĮbÓ¦ĪŖ____________”£
£Ø4£©²½Öč¢ō»¹æÉŅŌ»ŲŹÕNa2SO4Ą“ÖĘČ”Na2S”£
¢Ł¼ģŃéZnS¹ĢĢåŹĒ·ńĻ“µÓøɾ»µÄ·½·ØŹĒ £¬

¢ŚNa2SæÉÓɵČĪļÖŹµÄĮæµÄNa2SO4ŗĶCH4ŌŚøßĪĀ”¢“߻ƼĮĢõ¼žĻĀÖĘČ””£»Æѧ·“Ó¦·½³ĢŹ½ĪŖ__________£»
¢ŪŅŃÖŖNa2SO4”¤10H2O¼°Na2SO4µÄČܽā¶ČĖęĪĀ¶Č±ä»ÆĒśĻßČēĶ¼”£“ÓĀĖŅŗÖŠµĆµ½Na2SO4”¤10H2OµÄ²Ł×÷·½·ØŹĒ ”£
£Ø5£©Čō²½Öč¢ņ¼ÓČėµÄZnCO3ĪŖb mol£¬²½Öč¢óĖłµĆCdĪŖd mol£¬×īŗóµĆµ½VL”¢ĪļÖŹµÄĮæÅضČĪŖc mol/LµÄNa2SO4ČÜŅŗ”£ŌņĄķĀŪÉĻĖłÓĆŠæ»ŅÖŠŗ¬ÓŠŠæŌŖĖŲµÄÖŹĮæĪŖ____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£ØI£©¼×ĶéŌŚŅ»¶ØĢõ¼žĻĀæÉÉś³ÉŅŌĻĀĪ¢Į££ŗ
A£®Ģ¼ÕżĄė×Ó£ØCH3+£© B£®Ģ¼øŗĄė×Ó£ØCH3”Ŗ£©
C£®¼×»ł£Ø”ŖCH3£© D£®Ģ¼Ļ© £Ø©UCH2£©
¢ŁĖÄÖÖĪ¢Į£ÖŠ£¬¼ü½ĒĪŖ120”ćµÄŹĒ £ØĢīŠņŗÅ£©”£
¢ŚĢ¼øŗĄė×Ó£ØCH3”Ŗ£©µÄæռ乹ŠĶĪŖ £¬ÓėCH3”Ŗ»„ĪŖµČµē×ÓĢåµÄŅ»ÖÖ·Ö×ÓŹĒ £ØĢī»ÆѧŹ½£©
£ØII £©ŌŚÖĘČ”ŗĻ³É°±ŌĮĻĘųµÄ¹ż³ĢÖŠ£¬³£»ģÓŠŅ»Š©ŌÓÖŹ£¬ČēCO»įŹ¹“߻ƼĮÖŠ¶¾”£³żČ„COµÄ»Æѧ·½³ĢŹ½ĪŖ£ØHAc±ķŹ¾“×Ėį£©£ŗCu£ØNH3£©2Ac+CO+NH3=Cu£ØNH3£©3£ØCO£©Ac”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁC”¢N”¢OµÄµēøŗŠŌÓɓ󵽊”µÄĖ³ŠņĪŖ ”£
¢ŚŠ“³öCuµÄŗĖĶāµē×ÓÅŲ¼Ź½ ”£
¢Ū»ÆŗĻĪļCu£ØNH3£©3£ØCO£©AcÖŠ£¬½šŹōŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ ”£
¢ÜŌŚŅ»¶ØĢõ¼žĻĀNH3ŗĶCO2ÄÜŗĻ³ÉÄņĖŲCO£ØNH2£©2£¬ÄņĖŲÖŠCŌ×Ó¹ģµĄµÄŌÓ»ÆĄąŠĶĪŖ £»1molÄņĖŲ·Ö×ÓÖŠ£¬ ¦Ņ ¼üµÄŹżÄæĪŖ ”£
¢ŻCu2O¾§ĢåµÄ¾§°ū½į¹¹ČēĶ¼ĖłŹ¾£¬Čō°¢·üŁ¤µĀĀŽ³£ŹżĪŖNA£¬¾§°ūµÄ±ß³¤ĪŖa pm£¬Ōņ¾§ĢåµÄĆܶČĪŖ___ g”¤cm”Ŗ3”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠA”«I¾ÅÖÖĪļÖŹÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĘäÖŠ²æ·ÖÉś³ÉĪļ»ņ·“Ó¦Ģõ¼žŅŃĀŌČ„”£ŅŃÖŖAŌŚ³£ĪĀĻĀĪŖŗŚÉ«¹ĢĢåµ„ÖŹ£¬³£ĪĀĻĀC”¢E”¢F¶¼ŹĒĪŽÉ«ĘųĢ唣

Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©CµÄ¹ĢĢåĆū³Ę________£¬FµÄ»ÆѧŹ½ŹĒ________”£
£Ø2£© BµÄÅØČÜŅŗÓėA·“Ó¦¹ż³ĢÖŠ£¬BĢåĻֵĊŌÖŹÓėĻĀĮŠ·“Ó¦ÖŠHNO3ĢåĻֵĊŌÖŹĶźČ«ĻąĶ¬µÄŹĒ_____”£
A£®C+4HNO3(ÅØ£©![]() CO2+4NO2”ü+2H2O
CO2+4NO2ӟ+2H2O
B£®3Fe+8HNO3(Ļ” )=3Fe(NO3 )2+2NO”ü+4H2O
C£®Cu+4HNO3(ÅØ£©===Cu(NO3)2+2NO2”ü+2H2O
D£®2Fe2O3£«6HNO3===2Fe(NO3)3£«3H2O
£Ø3£©AÓėB·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ____________”£
£Ø4£©GÓėH·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ_________________________£»
CÓėµ»ĘÉ«¹ĢĢå·“Ó¦Éś³ÉFÓėGµÄ»Æѧ·½³ĢŹ½__________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ ŅŃÖŖĘū³µĪ²ĘųĪŽŗ¦»Æ“¦Ąķ·“Ó¦ĪŖ£ŗ2NO£Øg£©£«2CO £Øg£© ![]() N2£Øg£©£«2CO2£Øg£©”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø £©
N2£Øg£©£«2CO2£Øg£©”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø £©
A£®ĶØČė“óĮæNO£¬¦Ķ£ØÕż£©”¢¦Ķ£ØÄę£©¾łŌö“ó
B£®ŗćĪĀŗćČŻĻĀ³äČėNe£¬¦Ķ£ØÕż£©”¢¦Ķ£ØÄę£©¾ł²»±ä
C£®¦ĶÕż£ØNO£© =2¦ĶÄę£ØN2£©Ź±£¬·“Ó¦“ļµ½Ę½ŗā
D£®n £ØNO£©”Ćn £ØCO£©”Ćn £ØN2£©”Ćn £ØCO2£© =2”Ć2”Ć1”Ć2Ź±£¬·“Ó¦“ļµ½Ę½ŗā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø £©
A£®11.2 L CO2Ėłŗ¬·Ö×ÓŹżĪŖ0.5 NA
B£®1 L 0.1 molL©1µÄNa2SČÜŅŗÖŠĄė×ÓŹżĪŖ0.3 NA
C£®0.5 mol FeBr2Óė×ćĮæĀČĘų·“Ó¦×ŖŅʵĵē×ÓŹżĪŖNA
D£®14.2 g Na2SO4¹ĢĢåÖŠŅõĄė×ÓĖł“ųµēŗÉŹżĪŖ0.2 NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±¾ĢāĪŖ”¶»Æѧ·“Ó¦ŌĄķ(Ń”ŠŽ4)”·Ń”×öĢā”£
»ÆѧѧæĘÖŠµÄĘ½ŗāĄķĀŪÖ÷ŅŖ°üĄØ£ŗ»ÆŃ§Ę½ŗā”¢µēĄėĘ½ŗā”¢Ė®½āĘ½ŗāŗĶČܽāĘ½ŗāĖÄÖÖ£¬ĒŅ¾ł·ūŗĻĄÕĻÄĢŲĮŠŌĄķ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©³£ĪĀĻĀ£¬Ä³“æ¼ī(Na2CO3)ČÜŅŗÖŠµĪČė·ÓĢŖ£¬ČÜŅŗ³ŹŗģÉ«£¬ŌņøĆČÜŅŗ³Ź_____ŠŌ£¬ŌŅņŹĒ___________£»(ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾)
£Ø2£©ŌŚ³£ĪĀĻĀ½«pH=2µÄŃĪĖį10mL¼ÓĖ®Ļ”ŹĶµ½1L£¬ŌņĻ”ŹĶŗóµÄČÜŅŗµÄpHÖµµČÓŚ___________£»
£Ø3£©ŅŃÖŖŌŚH2SČÜŅŗÖŠ“ęŌŚĻĀĮŠĘ½ŗā£ŗH2S![]() HS-+H+
HS-+H+
¢ŁĻņH2SČÜŅŗÖŠ¼ÓČėNaOH¹ĢĢåŹ±£¬(²»æ¼ĀĒĪĀ¶Č±ä»Æ)µēĄėĘ½ŗāĻņ______ŅĘ¶Æ£¬(Ģī”°×ó”±»ņ”°ÓŅ”±)c(H+)_________”£(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)
¢ŚĻņH2SČÜŅŗÖŠ¼ÓČėNaHS¹ĢĢåŹ±£¬µēĄėĘ½ŗāĻņ______ŅĘ¶Æ£¬(Ģī”°×ó”±»ņ”°ÓŅ”±)c(S2-)_________”£(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)
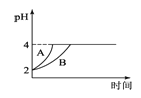
£Ø4£©³£ĪĀĻĀ£¬Č”pH=2µÄŃĪĖįŗĶ“×ĖįČÜŅŗø÷100mL£¬ĻņĘäÖŠ·Ö±š¼ÓČėŹŹĮæµÄZnĮ££¬·“Ó¦¹ż³ĢÖŠĮ½ČÜŅŗµÄpH±ä»ÆČēĶ¼1ĖłŹ¾£®ŌņĶ¼ÖŠ±ķŹ¾“×ĖįČÜŅŗÖŠpH±ä»ÆĒśĻߵďĒ________(Ģī”°A”±»ņ”°B”±)£»
£Ø5£©ÄŃČܵē½āÖŹŌŚĖ®ČÜŅŗÖŠ“ęŌŚČܽāĘ½ŗā”£Ä³MgSO4ČÜŅŗĄļc(Mg2+)=0.002molL-1£¬Čē¹ūÉś³ÉMg(OH)2³Įµķ£¬Ó¦µ÷ÕūČÜŅŗpH£¬Ź¹Ö®“óÓŚ________£»(øĆĪĀ¶ČĻĀMg(OH)2µÄKsp=2”Į10-11)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©ÓŠŅŌĻĀ°ĖÖÖ±„ŗĶČÜŅŗ£ŗ¢ŁBa(NO3)2£»¢ŚCa(OH)2£»¢ŪCa(ClO£©2£»¢ÜCaCl2£»¢ŻNa2CO3£»¢ŽNaAlO2£»¢ßNH3ŗĶNaCl£»¢ąNa2SiO3”£ĻņĘäÖŠ·Ö±š³ÖŠųĶØČėCO2£¬×īÖÕÄܵƵ½³Įµķ»ņĪö³ö¾§ĢåµÄ__ ”£
£Ø2£©øł¾ŻĻĀĮŠĆčŹöŠ“³öĻĀĮŠ»Æѧ·½³ĢŹ½£ŗ
¢ŁŅŃÖŖZnOŹōÓŚĮ½ŠŌŃõ»ÆĪļ£¬Š“³öZnOÓėNaOHČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ ”£
¢Ś ĮŖ°±£ØN2H4£©ŹĒŗ½Ģģ·É“¬³£ÓƵÄøßÄÜČ¼ĮĻ”£ĮŖ°±æÉŅŌ²ÉÓĆÄņĖŲCO(NH2)2]ĪŖŌĮĻÖĘČ”£¬·½·ØŹĒŌŚøßĆĢĖį¼Ų“߻ƼĮ“ęŌŚĻĀ£¬ÄņĖŲ”¾CO(NH2)2”æŗĶ“ĪĀČĖįÄĘ”¢ĒāŃõ»ÆÄĘČÜŅŗ·“Ӧɜ³ÉĮŖ°±”¢Ģ¼ĖįÄĘ”¢ĮķŅ»ÖÖÄĘŃĪŗĶĖ®£¬Š“³öĘä·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com