
【题目】实验室可用少量的溴和足量的乙醇制备1,2-二溴乙烷。制备装置如下图:

下列说法中不正确的是( )
A. 使用恒压滴液漏斗的目的是防止有机物挥发,使漏斗内液体顺利滴下
B. 实验中为了防止有机物大量挥发,应缓慢升高反应温度到170℃
C. 装置C 中应加入氢氧化钠溶液,以吸收反应中可能生成的酸性气体
D. 实验过程中应用冷水冷却装置D,以避免溴的大量挥发
【答案】B
【解析】分析:实验的目的是用少量的溴与足量乙醇制备1,2-二溴乙烷,实验的原理:CH3CH2OH![]() CH2=CH2↑+H2O、CH2=CH2+Br2→BrCH2CH2Br。根据装置图,装置A中CH3CH2OH与浓H2SO4的混合液迅速升温到170℃发生消去反应制备CH2=CH2,由于浓H2SO4具有强氧化性,CH3CH2OH具有还原性,由乙醇和浓H2SO4的混合液共热制得的乙烯中混有SO2、CO2等杂质气体,SO2也能与溴反应,气体通入装置D之前必须除去其中混有的酸性杂质气体。
CH2=CH2↑+H2O、CH2=CH2+Br2→BrCH2CH2Br。根据装置图,装置A中CH3CH2OH与浓H2SO4的混合液迅速升温到170℃发生消去反应制备CH2=CH2,由于浓H2SO4具有强氧化性,CH3CH2OH具有还原性,由乙醇和浓H2SO4的混合液共热制得的乙烯中混有SO2、CO2等杂质气体,SO2也能与溴反应,气体通入装置D之前必须除去其中混有的酸性杂质气体。
详解:A项,由于有机物乙醇易挥发,使用恒压滴液漏斗的目的是防止有机物挥发,使恒压滴液漏斗上下压强相等,使漏斗内液体顺利滴下,A项正确;B项,实验中由CH3CH2OH和浓H2SO4的混合液制CH2=CH2,为了减少副反应的发生,应迅速升温到170℃,B项错误;C项,由于浓H2SO4具有强氧化性,CH3CH2OH具有还原性,浓H2SO4会与CH3CH2OH发生氧化还原反应生成SO2、CO2和H2O,SO2也能与溴反应,装置C中加入NaOH溶液,用于吸收反应中可能生成的酸性气体,C项正确;D项,由于溴易挥发,为了提高原料的利用率,实验过程中应用冷水冷却装置D,以避免溴的大量挥发,D项正确;答案选B。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.14C和14N互为同位素
B.1H和2H是不同的核素,它们的化学性质相同
C.金刚石、石墨和C60互为同素异形体
D.CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的脱氧剂,其制备方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定条件下NaHSO3转化为Na2S2O5。完成下列填空:
(1)碳原子的原子结构示意图是_____________;CO2的化学键类型_______________________。
(2)从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。______________________。
(3)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其化学方程式为_____________________,证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________________。
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+H2O→Na2SO4+H2SO4,该反应中,氧化产物是_____;若反应中转移了0.04mol的电子,有____g Na2S2O5参加反应。
(5)连二亚硫酸钠Na2S2O4俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:
5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。为了测定保险粉纯度。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于锥形瓶中,用0.1000mol/L的KMnO4溶液滴定。重复上述操作2次,平均消耗KMnO4溶液21.00mL。则该样品中Na2S2O4的质量分数为________(杂质不参与反应)。(保留至0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
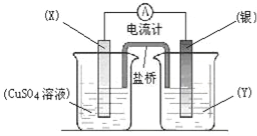
(1)电极X的材料是 (化学式);电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境内外、爱护地球已成为人们的共同呼声。下列事实不会造成大气污染的是
A. 汽车尾气的大量排放 B. 化石燃料的大量使用
C. 火山爆发喷出的大量SO2 D. 水力发电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙3种分子中含有相同数目的质子,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:

下列说法正确的是( )
A. C与A形成的常见化合物是同主族元素同类型化合物中沸点最低的
B. B是元素周期表中原子半径最小的元素
C. D的最高价氧化物的水化物一定是一种强酸
D. C的单质可以与D的氢化物发生置换反应生成D的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知和碳元素同主族的X元素位于周期表中的第1个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子是XY4。
试回答:
(1)X元素原子的基态电子排布式为________________________________________;Y元素原子最外层电子的电子排布图为________________________________________。
(2)该化合物的空间结构为__________,中心原子的杂化类型为__________,分子为__________ (填“极性”或“非极性”)分子。
(3)该化合物在常温下为液体,它的沸点与SiCl4的比较,__________ (填化学式)的高,原因是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
A. 分子总数为NA的二氧化硫和二氧化碳混合气体中含有的原子数为3NA
B. 任何条件下,20 L 氧气含有的分子数都不可能为NA
C. 在标准状况下,2 g氖气含有NA个氖原子
D. 物质的量相等的任何气体中都含有相同的原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由菱镁矿(主要成分MgCO3、CaCO3、FeCO3、SiO2)制备高纯氢氧化镁的工艺如下:
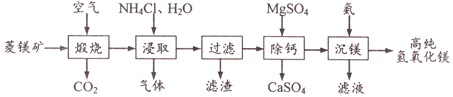
(1)“煅烧”时FeCO3发生反应的方程式为_____。
(2)“浸取”温度100℃左右,该步骤含镁化合物参与反应的化学方程式为______。
(3)“浸取”时NH4Cl用量对Mg2+浸出率的影响曲线如右图所示。下列有关说法正确的____(填序号)。
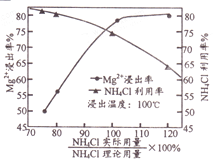
A.“浸取”时适当搅拌浆料
B.用超理论用量20%的NH4Cl进行浸取
C.可用NH4Cl对浸取后的滤渣进行二次浸取,将两次浸取液合并
D.浸出温度采用100℃可促进NH4Cl的水解和NH3的逸出
(4)本工艺流程中可循环利用的物质有______。
(5)若要得到高纯Mg(OH)2,需对“沉镁”步骤所得的固体进行洗涤,检验固体已洗净的方法是_______。
(6)25℃时,Ksp(CaSO4)=7.2×10-5。实验测得“除钙”前后溶液中c(Ca2+)分别为2.8g/L和0.8g/L,则1L溶液至少需加入MgSO4固体的质量为____g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com