
 在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )
在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )| A. | 固体F中含有配位键 | B. | D和E分子间均可形成氢键 | ||
| C. | A、B、C三种分子均属于非极性分子 | D. | E分子中中心原子的杂化类型为sp2 |
分析 在常温下A、B、C、D、E是5种常见的气体,F是固体,D分子是含有18个电子的异核双原子分子,E是4核10电子分子,D和E发生化合反应生成F,则D为HCl,E为NH3,F为NH4Cl,A与B发生化合反应生成D,B与C发生化合反应生成E,所以B为H2,A为Cl2,C为N2,据此答题.
解答 解:在常温下A、B、C、D、E是5种常见的气体,F是固体,D分子是含有18个电子的异核双原子分子,E是4核10电子分子,D和E发生化合反应生成F,则D为HCl,E为NH3,F为NH4Cl,A与B发生化合反应生成D,B与C发生化合反应生成E,所以B为H2,A为Cl2,C为N2,
A.F为NH4Cl,铵根离子中氮氢原子之间有配位键,故A正确;
B.D为HCl,氯化氢分子之间没有氢键,故B错误;
C.A为Cl2,B为H2,C为N2,三种分子均属于非极性分子,故C正确;
D.E为NH3,NH3分子中中心原子价层电子对数为$\frac{5+3}{2}$=4,所以氮原子的杂化类型为sp3,故D错误.
故选BD.
点评 本题考查无机物的推断,题目难度不大,注意把握题中信息,认真审题,为解答该题的关键,学习中注重相关基础知识的积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷和乙醇 | B. | 乙烷和乙醇 | C. | 苯和苯甲酸 | D. | 乙炔和苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | C--C | C=C | C--H | H一H |
| 键能(KJ•mol-1) | 348 | 610 | 413 | 436 |
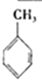 (g)+3H2(g)→
(g)+3H2(g)→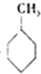 (g)△H=-384KJ•mol-1
(g)△H=-384KJ•mol-1| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C的质量数为14g•mol-1 | B. | 14C与14N中子数一定不同 | ||
| C. | 14C与C60互为同素异形体 | D. | 14C与12C是两种不同的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O原子发生sp杂化 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线型分子 | D. | HClO分子的结构式是:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁铵晶体要用冷水洗涤,而阿斯匹林过滤后则须用无水酒精洗涤 | |
| B. | 食醋总酸含量的测定实验中,若滴定终点没有控制好,即NaOH溶液滴加过量,则必须重做实验 | |
| C. | 火柴头中的氯元素检验的实验中,将火柴头(未燃烧)浸于水中,片刻后取少量溶液,加AgNO3溶液、稀硝酸,若出现白色沉淀,证明有氯元素 | |
| D. | 毒物误入口内,可将5~10mL稀硫酸铜溶液加入一杯温水中内服,人工促使呕吐出毒物后送医院 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 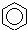 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$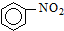 +H2O;取代反应 +H2O;取代反应 | |
| B. | CH4+Cl2→CH3Cl+HCl;置换反应 | |
| C. | CH2=CH2+HCl→CH3-CH2Cl;加成反应 | |
| D. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O;氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH4 | CO2 | CO | H2 |
| 物质的量mol | 2 | 2 | 8 | 8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com