
【题目】下列分子或离子中,中心原子不是sp3杂化的是
A.SO![]() B.NO
B.NO![]() C.CH4D.H2S
C.CH4D.H2S
【答案】B
【解析】
根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=![]() ,a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数。中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,据此判断。
,a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数。中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,据此判断。
A.硫酸根离子中,S原子价层电子对数=σ键个数+![]() =4+
=4+![]() =4,所以S采取sp3杂化,故A不选;
=4,所以S采取sp3杂化,故A不选;
B.NO![]() 中,N原子形成3个σ键,孤对电子数=
中,N原子形成3个σ键,孤对电子数=![]() ,中心原子N为sp2杂化,故B选;
,中心原子N为sp2杂化,故B选;
C.CH4分子中C原子价层电子对个数=4+![]() =4,所以C原子采用sp3杂化,故C不选;
=4,所以C原子采用sp3杂化,故C不选;
D.H2S中价层电子对个数=σ键个数+孤电子对个数=2+![]() =4,所以S原子采用sp3杂化,故D不选;
=4,所以S原子采用sp3杂化,故D不选;
故选:B。


科目:高中化学 来源: 题型:
【题目】丙炔酸甲酯(CH≡C-COOCH3 )是一种重要的有机化工原料,沸点为103℃。实验室制备少量丙炔酸甲酯的反应为:CH≡C-COOH+CH3OH![]() CH≡C-COOCH3+H2O。实验步骤如下:
CH≡C-COOCH3+H2O。实验步骤如下:
步骤1:在反应瓶中加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌加热回流一段时间;
步骤2:蒸出过量的甲醇(装置见图);
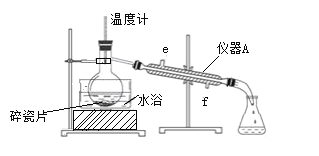
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤,分离出有机相;
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得7.56g丙炔酸甲酯。
(1)步骤1中,加入过量甲醇的目的是________。
(2)步骤2中,图中所示的装置中仪器A的名称是________,自来水从________(填“e”或“f”)进入该仪器;加入碎瓷片的目的是________。
(3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是________;分离出有机相的操作名称为________。
(4)步骤4中,蒸馏时不能用水浴加热的原因是________。
(5)丙炔酸甲酯的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液滴定10 mL 0.1 mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是( )

A.A点溶液中加入少量水:![]() 增大
增大
B.B点:c( HA -)>c(H+)>c(A2一)>c(H2A)
C.C点:c(Na+) =c(HA-)+2c( A2-)
D.水电离出来的c(OH -):B点>D点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中,有关微粒的物质的量浓度关系不正确的是![]()
![]()
A.![]() 溶液:
溶液:![]()
B.将![]() 溶液逐滴滴加到
溶液逐滴滴加到![]() 盐酸中:
盐酸中:![]()
C.![]() 溶液与等体积
溶液与等体积![]() 的醋酸混合后的溶液中:
的醋酸混合后的溶液中:![]()
D.![]() 溶液:
溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.lmol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________。
(4)丙组同学取5mL0.1mol·L-1KI溶液,加入3mL0.1mol·L-1FeCl3溶液混合,分别取2mL此混合溶液于2支试管中进行如下实验:
①第一支试管中加入1 mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴KSCN溶液,溶液变红。
实验②说明:在![]() 过量的情况下,溶液中仍含有________(填离子符号)。
过量的情况下,溶液中仍含有________(填离子符号)。
(5)丁组同学向盛有少量H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是一些常见物质之间的转化关系。A是一种红色金属,F为不溶于酸的白色沉淀,B和C是两种强酸。(图中部分产物及反应条件略去)

则:①A和B 分别为:A_________ B_________;
②A与B发生反应的条件是__________________;
③反应⑥的化学方程式为_____________________;
④上述反应中,不属于氧化还原反应的是_______________。(填数字序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜![]() 含杂质
含杂质![]() 与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
![]() 溶液B经过________、__________、___________可得到氯化铜晶体;
溶液B经过________、__________、___________可得到氯化铜晶体;
![]() 检验溶液B中是否存在
检验溶液B中是否存在![]() 的方法是_________;
的方法是_________;
![]() 下列物质适合于调节溶液的pH得溶液B的是________
下列物质适合于调节溶液的pH得溶液B的是________
A.NaOH溶液 ![]()
![]() 氨水
氨水 ![]()
![]() 已知元素在高价态时常表现氧化性,若在酸性
已知元素在高价态时常表现氧化性,若在酸性![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下![]() 的醋酸和
的醋酸和![]() 的硫酸两种溶液,下列叙述正确的是( )
的硫酸两种溶液,下列叙述正确的是( )
A.两溶液中水电离出的![]() 均为
均为![]()
B.加水稀释100倍后两溶液的pH仍相同
C.醋酸中的![]() 和硫酸中的
和硫酸中的![]() 相同
相同
D.等体积的两溶液中分别加入足量锌片时放出![]() 的体积相同
的体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+ O2(g) △H >0, T1温度下的部分实验数据为
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A.500s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1000s时N2O5转化率为50%
C.T1温度下的平衡常数为K1 ,T2温度下的平衡常数为K2,若K1<K2,则T1 >T2
D.平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5) >5.00mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com