
| A. | 铝 | B. | 铜 | C. | 银 | D. | 铁 |
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:选择题
| A. | 丙炔:CH≡C-CH3 | |
| B. | 丙烯:CH2CHCH3 | |
| C. | 2丁烯的结构简式为CH3CH═CHCH3,其键线式为 | |
| D. | 乙醇:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产中催化剂被大量使用是因为催化剂可以提高反应速率和转化率 | |
| B. | 合成氨的工业生产需在高温、高压和催化剂条件下进行是因为该反应是吸热反应 | |
| C. | 合成氨的工业生产中,及时将NH3液化分离出来将有利于提高生成物的产量 | |
| D. | 硫酸的工业生产中,SO2的催化氧化没有采用高压是因为压强对该反应无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ⑤ | C. | ④⑤ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某离子第三层上和第二层上的电子数均为第一层的4倍 | |
| B. | Cl-的结构示意图: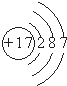 | |
| C. | 某物质的焰色反应为黄色,某物质一定为钠的化合物 | |
| D. | 14C和14N的质量数相等,互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 实验方案 |  |  |  |  加热大试管,一段时间后,蒸发皿中产生肥皂泡,点燃 |
| 目的 | 探究反应物浓度对化学平衡的影响 | 证明MnO2作该反应的催化剂 | 干燥并收集氨气 | 探究铁与水蒸气能否反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.20 | 1.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com