
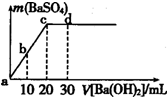
 常温下,向0.25mol/L的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是( )
常温下,向0.25mol/L的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是( )| A、溶液的pH:a<b<c<d |
| B、溶液的导电能力:a>b>d>c |
| C、a、b溶液呈酸性 |
| D、c、d溶液呈碱性 |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
| A、c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、c(Na+)>c(CH3COO-)>c(H+)=c(OH-) |
| D、c(Na+)=c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:HClO4>H3PO4>H2SO4 |
| B、氢化物的稳定性:H2S>HF>H2O |
| C、碱性:Al(OH)3>Mg(OH)2>NaOH |
| D、氧化性:F2>C12>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳和水反应吸收131.3kJ能量 |
| B、1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 |
| C、1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
| D、1个固态碳原子和1个水蒸气分子反应吸热131.1kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2L1mol/LNa2SO4溶液中含有的离子总数为3NA |
| B、16 g CH4所含原子数目为NA |
| C、18g NH4+ 所含电子数目为11NA |
| D、18 g水所含分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com